题目内容
【题目】资源的高效利用对保护环境、促进经济持续健康发展具有重要作用,如回收利用电解精炼铜的阳极泥中含有的银、铂、金等贵重金属。提炼阳极泥的方法有多种,湿法提炼是其中重要的一种,其主要生产流程如下:
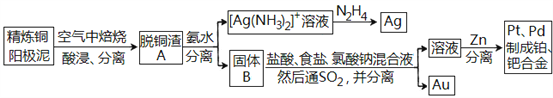
请回答下列问题:
(1)各步生产流程中都涉及了同一种分离方法,该方法需要的玻璃仪器有玻璃棒和_______。
(2)脱铜渣A中含有AgCl,它溶于浓氨水的离子方程式为________________。
(3)已知N2H4被银氨溶液氧化的产物是氮气,则每生成1molAg,需要消耗_______g N2H4。
(4)固体B中单质Au在酸性环境下与NaClO3、NaCl反应生成NaAuCl4;在NaAuCl4中Au元素的化合价为______,该反应的离子方程式为____________________。
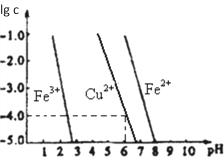
(5)阳极泥中的铜可以用FeC13溶液浸出,所得溶液主要含有的阳离子为Cu2+、Fe3+和Fe2+;结合如图分析:(其中的纵坐标代表金属阳离子浓度的对数)
①要从浸出液中提纯铜,最好先加入酸化的双氧水,目的是_______________,然后加入适量的CuO调节pH=3.7,除去______离子;
②从图中数据计算可得Cu(OH)2的Ksp约为_______________。
【答案】 烧杯、漏斗 AgCl + 2NH3·H2O![]() [Ag (NH3)2]+ + Cl- + 2H2O 8 +3价 2Au + ClO3- + 7 Cl- +6H+
[Ag (NH3)2]+ + Cl- + 2H2O 8 +3价 2Au + ClO3- + 7 Cl- +6H+ ![]() 2 AuCl4- + 3H2O 将Fe2+氧化为Fe3+ Fe3+ 1.0×10-20
2 AuCl4- + 3H2O 将Fe2+氧化为Fe3+ Fe3+ 1.0×10-20
【解析】(1)各步生产流程中都涉及了同一种分离方法将固体和溶液分开,是过滤操作,该方法需要的玻璃仪器有玻璃棒和烧杯、漏斗;(2)脱铜渣A中含有AgCl,它溶于浓氨水生成络合离子的离子方程式为:AgCl + 2NH3·H2O![]() [Ag (NH3)2]+ + Cl- + 2H2O;(3)根据化学反应N2H4+4Ag(NH3)2OH+=N2↑+4Ag↓+4H2O+8NH3↑可知,每生成1molAg,需要消耗
[Ag (NH3)2]+ + Cl- + 2H2O;(3)根据化学反应N2H4+4Ag(NH3)2OH+=N2↑+4Ag↓+4H2O+8NH3↑可知,每生成1molAg,需要消耗![]() N2H4;(4)设在NaAuCl4中Au元素的化合价为x,则+1+x+(-1)×4=0,解得x=+3, Au在酸性环境下与NaClO3、NaCl反应生成NaAuCl4的离子方程式为:2Au + ClO3- + 7 Cl- +6H+
N2H4;(4)设在NaAuCl4中Au元素的化合价为x,则+1+x+(-1)×4=0,解得x=+3, Au在酸性环境下与NaClO3、NaCl反应生成NaAuCl4的离子方程式为:2Au + ClO3- + 7 Cl- +6H+ ![]() 2 AuCl4- + 3H2O;(5)①要从浸出液中提纯铜,最好先加入酸化的双氧水,将Fe2+氧化为Fe3+;然后加入适量的CuO调节pH=3.7, Fe3+离子转化为沉淀而除去;②由图中可知,当PH=6时,lgc(Cu2+)=-4,则c(OH-)=10-8mol/L,c(Cu2+)=10-4mol/L,故Ksp Cu(OH)2= c(Cu2+)c2(OH-)=10-4mol/L×(10-8mol/L)2=10-20mol3/L3。
2 AuCl4- + 3H2O;(5)①要从浸出液中提纯铜,最好先加入酸化的双氧水,将Fe2+氧化为Fe3+;然后加入适量的CuO调节pH=3.7, Fe3+离子转化为沉淀而除去;②由图中可知,当PH=6时,lgc(Cu2+)=-4,则c(OH-)=10-8mol/L,c(Cu2+)=10-4mol/L,故Ksp Cu(OH)2= c(Cu2+)c2(OH-)=10-4mol/L×(10-8mol/L)2=10-20mol3/L3。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下列实验操作规范且能达到目的的是( )
目的 | 操作 | |
A. | 取20.0 mL盐酸 | 用50ml量筒量取,读数时仰视刻度线 |
B. | 清洗碘升华实验所用试管 | 先用酒精清洗,再用水清洗 |
C. | 测定醋酸钠溶液pH | 用玻璃棒蘸取溶液,点在湿润的pH试纸上 |
D. | 配制浓度为0.010 | 称取KMnO4固体0.158 g,放入100 mL容量瓶中,加水溶解并稀释至刻度 |
A.A B.B C.C D.D