题目内容
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2]是一种重要的化工原料,下列有关说法正确的是
A. Na+、Fe3+、NO3-、C12都可在该物质的溶液中大量共存
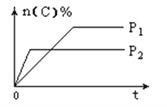
B. 向0. 1 mol/L该物质的溶液中逐滴滴加0. 1mol/L NaOH溶液,生成沉淀的物质的量与逐滴加入NaOH溶液体积关系如图所示

C. 检验该物质中Fe2+是否变质的方法是向该物质的溶液中滴入儿滴KSCN溶液,观察溶液是否变红色
D. 向该物质的溶液中滴加Ba(OH)2溶液,恰好使SO42-完全沉淀的离子方程式为 Fe2++2SO42-+2Ba2++2OH-=2BaSO4↓+Fe(OH)2↓
【答案】C
【解析】试题分析:A.Fe2+ 有还原性,可被Cl2氧化为Fe3+而不能大量共存,错误;B.滴加NaOH溶液,首先是Fe2+ 先与OH反应生成白色沉淀,然后是发生反应:NH4++OH-=NH3H2O,图像与发生的反应事实不符合,错误;C.若Fe2+ 被氧化为变质为Fe3+,只需滴入几滴KSCN溶液,可观察到溶液变为红色,因此可鉴别,正确;D. 向该物质的溶液中摘加Ba(OH)2溶液,恰好使SO42-完全沉淀的离子方程式为Fe2++ 2NH4++ 2SO42-+ 2Ba2++4OH-=2BaSO4↓+Fe(OH)2↓+2 NH3H2O,,漏掉NH4+与OH-的反应,故错误。

【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),
CO(g)+H2O(g),
其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K =__________________。
(2)该反应为__________反应(“吸热”或“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是_______________。
a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为________℃。