题目内容
相同物质的量浓度的下列溶液中pH最大的是( )
| A、KOH | B、NH3?H2O | C、HCl | D、H2SO4 |
分析:题中HCl和H2SO4都呈酸性,KOH、NH3?H2O呈碱性,等浓度时,溶液碱性越强,pH越大,以此解答.
解答:解:HCl和H2SO4都呈酸性,pH<7,KOH、NH3?H2O呈碱性,pH>7,KOH为强碱,NH3?H2O为弱碱,等浓度时,溶液碱性越强,pH越大,则pH最大的为KOH.
故选A.
故选A.
点评:本题考查了电解质的电离,难度不大,注意常见溶液的酸碱性与pH的关系,把握电解质的强弱的判断,注意相关基础知识的积累.

练习册系列答案
相关题目
已知同温度、同物质的量浓度的NaX溶液的pH值大于NaY溶液的pH值,据此,下列对两种对应酸(HX和HY)在相同温度和浓度下的比较中正确的是( )
| A、c(X-)>c(Y-) | B、电离程度:HX>HY | C、HY溶液的pH值>HX溶液的pH | D、HY溶液中的c(H+)>HX溶液中的c(H+) |
中学化学教材中有大量数据,下列为某同学对数据的利用情况,其中不正确的是( )
| A、用沸点数据推测两种液体混合物用蒸馏方法分离开来的可能性 | B、用几种一元弱酸的电离常数Ka来比较相同温度下相同物质的量浓度的这几种一元弱酸的钠盐溶液的碱性强弱 | C、用几种相同类型的难溶电解质的Ksp来比较相同温度下它们的溶解度的大小 | D、用熔、沸点数据来分析分子的稳定性 |
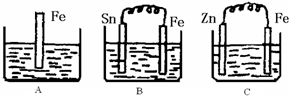
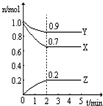
 2Z
2Z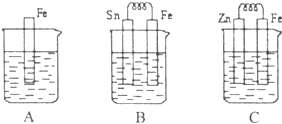 I.A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.
I.A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.