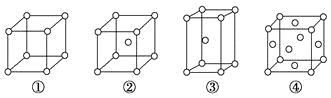
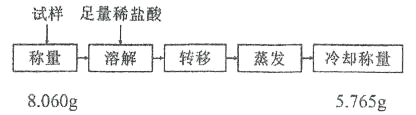
题目内容
【题目】下表是元素周期表的一部分,针对表中的①⑩种元素,填写下列空白:
周期 | IA | IIA | ⅢA | IVA | VA | VIA | ⅦA |
1 | ① | ||||||
2 | ② | ③ | ④ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)上述元素中,形成化合物种类最多的是______(填元素符号)。
(2)元素①、④和⑤形成的化合物的电子式是______,该化合物中存在的化学键类型是______。
(3)②、③、⑦三种元素原子半径由大到小的顺序是______(用元素符号表示)。
⑤、⑥、⑦、⑧、⑨、⑩六种元素形成的简单离子,半径最小的是_________,最大的是___________(填离子符号)。
(4)⑤、⑥、⑦三种元素最髙价氧化物对应水化物的碱性由强到弱的顺序是______(用对应物质的化学式表示)。
(5)最易形成离子键的两种元素代号是_____________。
(6)能比较元素⑨和⑩非金属性强弱的实验事实是______(填字母序号)。
a.⑨的氢化物的酸性比⑩的氢化物的酸性弱
b.⑩的单质R2与H2化合比⑨的单质Q与H2化合容易,且HR的稳定性比H2Q强
c.在⑨的氢化物H2Q的水溶液中通少量⑩的单质R2气体可置换出单质Q
【答案】C ![]() 离子键、极性键(或共价键) Al、C、N(或者Al>C>N) Al3+ P3- NaOH>Mg(OH)2>Al(OH)3 ④⑤ bc
离子键、极性键(或共价键) Al、C、N(或者Al>C>N) Al3+ P3- NaOH>Mg(OH)2>Al(OH)3 ④⑤ bc
【解析】
由元素在周期表中的位置可知,①为H,②为C,③为N,④为O,⑤为Na, ⑥为Mg,⑦为Al,⑧为P,⑨为S,⑩为Cl,据此分析作答。
根据上述分析知,
(1)形成化合物种类最多的是C,
故答案为:C;
(2)元素①、④和⑤形成的化合物为NaOH,为离子化合物,其电子式为:![]() ,化合物存在的化学键为离子键与极性键(或共价键),
,化合物存在的化学键为离子键与极性键(或共价键),
故答案为:![]() ;离子键、极性键(或共价键);
;离子键、极性键(或共价键);
(3)同周期中,原子半径从左到右依次减小,同主族中,原子半径依次增大,则②、③、⑦三种元素分别是C、N和Al,所以其原子半径从大到小为:Al、C、N(或者Al>C>N),电子层数大的对应元素简单离子半径大,电子层数相同的,核电荷数小的元素简单例子半径大,则⑤、⑥、⑦、⑧、⑨、⑩元素对应的离子半径最小的是Al3+,最大的则是P3-,
故答案为:Al、C、N(或者Al>C>N);Al3+;P3-;
(4)元素的金属性越强,其最髙价氧化物对应水化物的碱性越强,则⑤、⑥、⑦三种元素最髙价氧化物对应水化物的碱性由强到弱的顺序是NaOH>Mg(OH)2>Al(OH)3,
故答案为:NaOH>Mg(OH)2>Al(OH)3;
(5)金属性较强的元素与非金属性较强的元素易形成离子键,上述元素中,金属性最强的元素为钠,非金属性最强的是氧,所以最易形成离子键两种元素代号是④⑤,
故答案为:④⑤;
(6)a.气态氢化物的稳定性可比较非金属性,而不是酸性,a项错误;
b.⑩的单质R2与H2化合比⑨的单质Q与H2化合容易,且HR的稳定性比H2Q强,可说明⑩的非金属性比⑨强,b项正确;
c.R2能从H2Q将Q置换出来,根据氧化剂的氧化性大于氧化产物的氧化性可知,R2的氧化性大于Q,即R元素非金属性大于Q,c项正确;
答案为bc。

 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案