题目内容
18.X、Y、Z、W、R是5种短周期元素,其原子序数依次增大.X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的质子数之和相等.下列说法正确的是( )| A. | 元素Y、Z具有相同电子层结构的离子,其离子半径大小为Y<Z | |
| B. | 元素X不能与元素Y形成化合物X2Y2 | |
| C. | 元素Y、R分别与元素X形成的化合物的热稳定性:XmY>XmR | |
| D. | 元素W、R的最高价氧化物的水化物都是强酸 |
分析 X是周期表中原子半径最小的元素,应为H元素,Y原子最外层电子数是次外层电子数的3倍,应为O元素;根据Z、W、R处于同一周期,R与Y处于同一族,则R为S元素;Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等,则Z、W原子的核外电子数之和为8+16=24,又Z、W、处于同一周期,应为第三周期,分别为Na和Al元素,其中:
A、根据核外电子排布相同的微粒,半径随着核电荷数的增加而减小进行判断;
B、根据推断得知X和Y分别为H和O元素,可知形成的常见化合物有H2O和H2O2;
C、根据非金属强弱判断氢化物的稳定性;
D、根据金属性和非金属性判断碱和酸的强弱
解答 解:A、从题目所给的条件可以看出X是H元素,Y是O元素,Z是Na元素,W是Al元素,R是S元素,Y、Z具有相同电子层结构的离子(O2-、Na+),根据核外电子排布相同的微粒,半径随着核电荷数的增加而减小,其半径依次减小,故A错误;
B、X和Y元素能形成2种化合物,X2Y(H2O)和X2Y2(H2O2),故B错误;
C、元素Y、R分别与元素X形成的化合物是氢化物,因为Y(O元素)和R(S元素)的非金属性强弱:Y>R,所以对应的氢化物的稳定性:XmY>XmR,故C正确;
D、W元素最高价氧化物的水化物是Al(OH)3,是弱碱,而R元素最高价氧化物的水化物是H2SO4,是强酸,故D错误.
故选C.
点评 本题考查元素周期律的运用,做题时注意以下问题:①同周期、同主族内元素性质(核外电子排布、原子半径、金属性、非金属性、酸碱性、气态氢化物的热稳定性等)变化规律.②元素之间化合所形成化合物的化学式的书写.

练习册系列答案
相关题目
8.下列反应不属于氧化还原反应的是( )
| A. | Al (OH)3+3HCl═AlCl3+3H2O | B. | 3Fe+4H2O(g)=Fe3O4+4H2 | ||
| C. | 3NO2+H2O═2HNO3+NO | D. | Cl2+H2O═HCl+HClO |
9.下列事故或药品的处理正确的是( )
| A. | 少量浓硫酸沾到皮肤上,立即用氢氧化钠溶液冲洗 | |
| B. | 制取并用排水法收集氧气结束后,应立即停止加热 | |
| C. | 将含硫酸的废液倒入水槽,用水冲入下水道 | |
| D. | 当出现CO中毒时,应立即将中毒者抬到室外新鲜空气处 |
6.下列气体溶于水后的溶液能使酚酞试液显红色的是( )
| A. | Cl2 | B. | NO2 | C. | SO2 | D. | NH3 |
13.下列反应既是离子反应,又是氧化还原反应的是( )
| A. | 氯化钠溶液中滴入硝酸银溶液 | |
| B. | 氢气还原氧化铜 | |
| C. | 铁片置于硫酸铜溶液中 | |
| D. | 用氢氧化钠溶液溶解带氧化膜的铝片 |
3.下列各图中所示的实验方法、装置和操作都正确是( )
| A. | 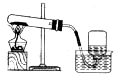 制取、收集O2 制取、收集O2 | B. | 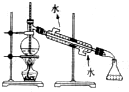 制无水乙醚 制无水乙醚 | ||
| C. | 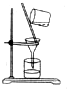 除去NaCl中的泥沙 除去NaCl中的泥沙 | D. |  收集NO 收集NO |
10.下列离子方程式中,正确的是( )
| A. | 氯气通入氢氧化钠溶液中 2Cl2+2OH-═3Cl-+ClO-+H2O | |
| B. | 盐酸与石灰石反应:2H++CO32-═H2O+CO2↑ | |
| C. | 锌与稀硫酸反应:Zn+2H+═Zn2++H2↑ | |
| D. | 硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ |
7.下列化合物中的所有碳原子可以在同一平面上的是( )
| A. | 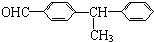 | B. | 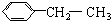 | ||
| C. | CH2=CHCH=CHCH=CH2 | D. | (CH3)2CH-C≡C-CH=CHCH3 |
8.下列有关热化学反应的说法中正确的是( )
| A. | 放热反应比吸热反应更容易发生 | |
| B. | 凡是在加热或点燃条件下进行的反应都是吸热反应 | |
| C. | 向1L 1 mol/L NaOH溶液中加入一定量浓H2SO4溶液至恰好反应完全时,共放出65 kJ的热量.则表示该反应的中和热的热化学方程式为:$\frac{1}{2}$H2SO4(aq)+NaOH(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-65kJ•mol-1 | |
| D. | 已知:2CO(g)+O2(g)═2CO2(g)△H=-566 kJ•mol-1,由此可知CO的燃烧热为283 kJ•mol-1 |