题目内容
【题目】欲用98%的浓硫酸(g=1.84g·cm-3)配制成浓度为0.5mol·L-1的稀硫酸500ml。
(1)选用的主要仪器有:
①________,②_________,③__________,④__________,⑤____________。
(2)请将下列各操作,按正确的序号填在横线上。
A.用量筒量取浓H2SO4 B.反复颠倒摇匀
C.用胶头滴管加蒸馏水至刻度线 D.洗净所用仪器
E.稀释浓H2SO4 F.将溶液转入容量瓶
其操作正确的顺序依次为____________________________。
(3)简要回答下列问题:
①所需浓硫酸的体积为____________mL。
②如果实验室有15mL、20mL、50mL的量筒应选用____________mL的量筒最好,量取时发现量筒不干净用水洗净后直接量取将使浓度__________(“偏高”、“偏低”、“无影响”)
③将浓硫酸沿烧杯内壁慢慢注入盛水的烧杯中,并用玻璃棒不断搅拌的目的是____________,若搅拌过程中有液体溅出结果会使浓度偏____________。
④在转入容量瓶前烧杯中液体应____________,否则会使浓度偏____________;并洗涤烧杯和玻璃棒2~3次,洗涤液也要转入容量瓶,否则会使浓度____________。
⑤定容时必须使溶液凹液面与刻度线相切,若俯视会使浓度____________;仰视则使浓度____________。
【答案】 量筒 烧杯 玻璃棒 500mL容量瓶 胶头滴管 D、A、E、F、D、C、B 13.6 15 偏低 防止暴沸,迅速散热 低 静置冷却 高 偏低 偏高 偏低
【解析】本题主要考查一定物质的量浓度溶液的配制方法及误差分析。
(1)选用的主要仪器有:①量筒,②烧杯,③玻璃棒,④500Ml容量瓶,⑤胶头滴管。
(2) 配制稀硫酸的步骤依次为洗净所用仪器,根据计算结果用量筒量取浓硫酸,在小烧杯中稀释浓硫酸,稀硫酸冷却至室温后将溶液转移至容量瓶,洗涤小烧杯,定容,摇匀,故其操作正确的顺序依次为D、A、E、F、D、C、B。
(3)①c浓=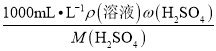 =
=![]() =18.4mol/L。c浓V浓= c稀V稀,V浓=c稀V稀/c浓=13.6mL,故所需浓硫酸的体积为13.6mL。
=18.4mol/L。c浓V浓= c稀V稀,V浓=c稀V稀/c浓=13.6mL,故所需浓硫酸的体积为13.6mL。
②所选量筒规格接近于且不小于13.6mL,应选用15mL的量筒最好,量取时发现量筒不干净用水洗净后直接量取将使浓硫酸被稀释而使所配稀硫酸浓度偏低。
③将浓硫酸沿烧杯内壁慢慢注入盛水的烧杯中,并用玻璃棒不断搅拌的目的是防止暴沸,迅速散热,若搅拌过程中有液体溅出结果会使浓度因溶质减少而偏低。
④在转入容量瓶前烧杯中液体应冷却至室温,否则冷却后溶液体积减小会使浓度偏高;并洗涤烧杯和玻璃棒2~3次,洗涤液也要转入容量瓶,否则会使浓度因溶质减少而偏低。
⑤定容时必须使溶液凹液面与刻度线相切,若俯视会使溶液体积变小而浓度偏高;仰视则使溶液体积增大而浓度偏低。

【题目】Ⅰ.现有下列十种物质:①O2;②Fe;③CaO;④CO2;⑤H2SO4;⑥Ba(OH)2;⑦红褐色的氢氧化铁胶体;⑧硫酸钠溶液;⑨稀硝酸;⑩Cu2(OH)2CO3。
(1)按物质的树状分类法填写表格的空白处:
分类标准 | 金属单质 | 氧化物 | 溶液 | 胶体 |
属于该类的物质 | ② | _____ | ⑧⑨ | _____ |
(2)上述物质中属于非电解质的有_________;上述物质中能与盐酸反应的电解质有________。
Ⅱ.(1)在 KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O 的反应中,氧化剂是_________,还原产物是_________,氧化产物与还原产物的质量比是_________。
(2)在反应MnO2+4HCl=MnCl2+Cl2↑+2H2O中,每生成标准状况下4.48LCl2,转移电子的数目为___________。
Ⅲ.Mn2+、Bi3+、BiO3-、MnO4-、H+、H2O组成的一个氧化还原反应体系中,发生BiO3-→Bi3+的反应过程,据此回答下列问题:
将以上物质分别填入下面对应的横线上,组成一个未配平的化学方程式。
________+ _________+ ________![]() _________+ ________+H2O
_________+ ________+H2O
【题目】下列实验现象或图像信息不能充分说明相应的化学反应是放热反应的是( )
A | B | C | D | |
反应 装置或 图像 |
|
|
|
|
实验现 象或图 像信息 | 反应开始 后,针筒活 塞向右移动 | 反应物总能 量大于生成 物总能量 | 反应开始后, 甲处液面低 于乙处液面 | 温度计的 水银柱不 断上升 |
A. A B. B C. C D. D




