题目内容
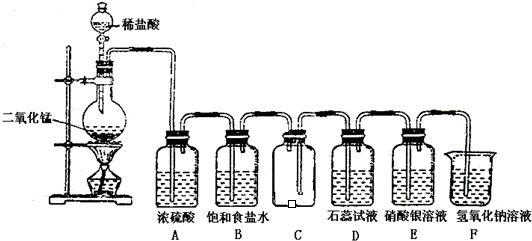
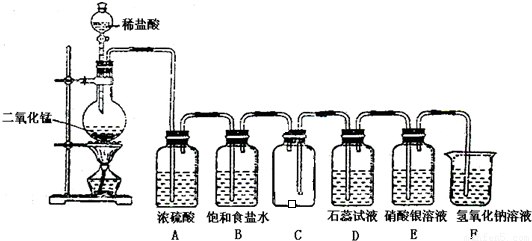
如图是一位学生设计的实验室制取和收集氯气并验证其性质的装置图.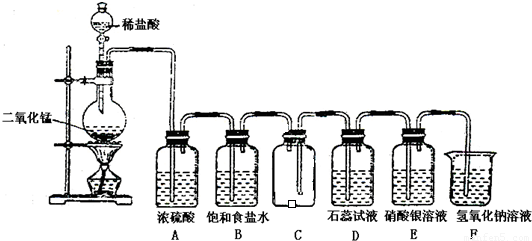
(1)找出在此装置图中出现的错误加以改正______.
(2)实验过程中,在D装置中观察到的实验现象是______;在E装置中观察到的实验现象是______,反应的化学方程式是______;
(3)F装置的作用是______,反应的离子方程式是______.
【答案】分析:(1)根据实验室制用浓盐酸和二氧化锰在加热条件下制氯气;除杂时先除去氯化氢,再除去水蒸气,最后收集,采用向下排空法收集密度大于空气的气体时应从长管进短管出;
(2)根据氯气与水反应生成盐酸和次氯酸,盐酸具有酸性,次氯酸具有强氧化性,能用于漂白;盐酸能与硝酸银反应生成氯化银白色沉淀;
(3)根据氯气有毒,为防止污染空气,应用碱液来吸收.
解答:解:(1)实验室制用浓盐酸和二氧化锰在加热条件下制氯气;除杂时先除去氯化氢,再除去水蒸气,最后收集;氯气的密度大于空气,采用向下排空法收集时应从长管进短管出;
故答案为:稀盐酸改用浓盐酸;B应在A的左边;C中进气管应该长,排气管应该短;
(2)氯气与水反应生成盐酸和次氯酸:Cl2+H2O=HClO+HCl,盐酸具有酸性,能使紫色石蕊试液变红,次氯酸具有强氧化性,能用于漂白,所以溶液红色褪去,盐酸能与硝酸银反应生成氯化银白色沉淀:HCl+AgNO3=AgCl↓+HNO3,所以在E装置中观察到的实验现象是有白色沉淀生成;
故答案为:溶液先变红后褪色;有白色沉淀生成;Cl2+H2O=HClO+HCl、HCl+AgNO3=AgCl↓+HNO3;
(3)氯气有毒,为防止污染空气,应用碱液来吸收:Cl2+2OH-=ClO-+Cl-+H2O;
故答案为:吸收多余的氯气,防止污染环境;Cl2+2OH-=ClO-+Cl-+H2O.
点评:本题主要考查实验室制氯气的原理和氯气的性质,难度不大,掌握原理和物质的性质即可解答,需要注意的是浓盐酸和二氧化锰能反应,但稀盐酸和二氧化锰不反应;次氯酸是弱酸,但次氯酸具有强氧化性.
(2)根据氯气与水反应生成盐酸和次氯酸,盐酸具有酸性,次氯酸具有强氧化性,能用于漂白;盐酸能与硝酸银反应生成氯化银白色沉淀;
(3)根据氯气有毒,为防止污染空气,应用碱液来吸收.
解答:解:(1)实验室制用浓盐酸和二氧化锰在加热条件下制氯气;除杂时先除去氯化氢,再除去水蒸气,最后收集;氯气的密度大于空气,采用向下排空法收集时应从长管进短管出;
故答案为:稀盐酸改用浓盐酸;B应在A的左边;C中进气管应该长,排气管应该短;
(2)氯气与水反应生成盐酸和次氯酸:Cl2+H2O=HClO+HCl,盐酸具有酸性,能使紫色石蕊试液变红,次氯酸具有强氧化性,能用于漂白,所以溶液红色褪去,盐酸能与硝酸银反应生成氯化银白色沉淀:HCl+AgNO3=AgCl↓+HNO3,所以在E装置中观察到的实验现象是有白色沉淀生成;
故答案为:溶液先变红后褪色;有白色沉淀生成;Cl2+H2O=HClO+HCl、HCl+AgNO3=AgCl↓+HNO3;
(3)氯气有毒,为防止污染空气,应用碱液来吸收:Cl2+2OH-=ClO-+Cl-+H2O;
故答案为:吸收多余的氯气,防止污染环境;Cl2+2OH-=ClO-+Cl-+H2O.
点评:本题主要考查实验室制氯气的原理和氯气的性质,难度不大,掌握原理和物质的性质即可解答,需要注意的是浓盐酸和二氧化锰能反应,但稀盐酸和二氧化锰不反应;次氯酸是弱酸,但次氯酸具有强氧化性.

练习册系列答案
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案
相关题目