题目内容
【题目】硫酰氯(SO2Cl2)是一种重要的化工试剂,合成硫酰氯的实验装置如下图:
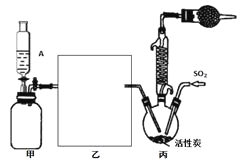
已知:①SO2(g)+Cl2(g)SO2Cl2(g) H=-97.3kJ/mol;
②硫酰氯通常条件下为无色液体,熔点为-54.1℃,沸点为69.1℃,在潮湿空气中“发烟”;100℃以上开始分解,生成二氧化硫和氯气,长期放置也会发生分解。
回答下列问题:
(1)装置甲为储气装置,用于提供氯气,则仪器A中盛放的试剂为______________。装置丙中活性炭的作用是______________。
(2)在上图方框内所缺装置为洗气瓶,瓶内应装的试剂是______________________。
(3)氯磺酸(ClSO3H)加热分解,也能制得硫酰氯与另外一种物质,该反应的化学方程式为_______,分离产物的方法是(填字母)____。
A.重结晶 B.过滤 C.蒸馏 D.萃取
(4)为提高本实验中硫酰氯的产率,在实验操作中需要注意的事项有________(填序号)。
①先通冷凝水,再通气 ②控制气流速率,宜慢不宜快
③若三颈烧瓶发烫,可适当降温 ④加热三颈烧瓶
(5)在无活性炭存在的条件下SO2与Cl2也可发生反应,现将SO2、Cl2按照一定比例通入水中,请设计一个简单实验验证二者是否恰好完全反应:__________(简要描述实验步骤、现象和结论)。仪器自选,供选择试剂:滴加酚酞的氢氧化钠溶液、碘化钾溶液、淀粉溶液、品红溶液。
【答案】饱和食盐水 催化剂 浓硫酸 2ClSO3H![]() SO2Cl2+H2SO4 C ①②③ 取少量溶液,向其中加入品红溶液,若品红溶液不褪色,说明二者恰好完全反应,否则,二者未完全反应
SO2Cl2+H2SO4 C ①②③ 取少量溶液,向其中加入品红溶液,若品红溶液不褪色,说明二者恰好完全反应,否则,二者未完全反应
【解析】
根据装置图可知,装置甲为储气装置,用于提供氯气,则仪器A中盛放的试剂要将氯气压入后续反应装置,所以不能溶解氯气,应为饱和食盐水,硫酰氯易水解,所以生成的氯气要干燥,所以乙中应装有浓硫酸干燥氯气,氯气与二氧化硫反应需要用活性碳作催化剂,硫酰氯易水解易挥发,所以在三颈烧瓶上方应连接一个冷凝管和装有碱石灰的干燥管,则甲中活性炭的作用是催化剂。
(1)根据上面的分析可知,仪器A中盛放的试剂为饱和食盐水,装置丙中活性炭的作用是催化剂;
(2)根据上面的分析可知,在如图方框内画出所缺装置为浓硫酸干燥氯气的装置;
(3)氯磺酸(ClSO3H)加热分解,也能制得硫酰氯与另外一种物质,根据原子守恒可知另一种生成物是硫酸,因此该反应的化学方程式为2ClSO3H![]() SO2Cl2+H2SO4;硫酰氯通常条件下为无色液体,熔点为-54.1℃,沸点为69.1℃,而硫酸沸点高,则分离产物的方法是蒸馏;
SO2Cl2+H2SO4;硫酰氯通常条件下为无色液体,熔点为-54.1℃,沸点为69.1℃,而硫酸沸点高,则分离产物的方法是蒸馏;
(4)由于硫酰氯通常条件下为无色液体,熔点为-54.1℃,沸点为69.1℃,在潮湿空气中“发烟”;100℃以上开始分解,生成二氧化硫和氯气,长期放置也会发生分解,因此为提高本实验中硫酰氯的产率,在实验操作中需要注意的事项有①先通冷凝水,再通气,②控制气流速率,宜慢不宜快,③若三颈烧瓶发烫,可适当降温,但不能加热三颈烧瓶,否则会加速分解;
(5)二氧化硫溶液与氯水都可以漂白品红溶液,若二者恰好完全反应得到盐酸、硫酸,不能使品红溶液褪色,检验方案为:取少量溶液,向其中加入品红溶液,若品红溶液不褪色,说明二者恰好完全反应,否则,二者未完全反应。

 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案【题目】某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请填写下列空白。
(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视____,直到因加入一滴盐酸后,溶液由______色变为____色,并____为止。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是__________。
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则起始读数为_____mL,所用盐酸溶液的体积为_____mL。

(4)某学生根据3次实验分别记录有关数据如表:
滴定 次数 | 待测NaOH溶液的体积/mL | 0.1000mol·L-1盐酸的体积/mL | ||
滴定前读数 | 滴定后读数 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 25.11 | 25.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 25.31 | 25.09 |
依据表中数据列式计算该NaOH溶液的物质的量浓度_____(保留两位小数)。

