题目内容
称取金属钠、铝、铁各mg,在室温下分别与VL2mol?L-1的硫酸充分反应。试写出下列四种情况下V的取值范围(用含m的表达式表示):(1)若铝与硫酸反应放出的H2最多时,__________。
(2)若钠与硫酸反应放出的H2最多时,__________。
(3)若铝、铁分别与VL硫酸反应放出的H2一样多时,__________。
(4)若钠、铝分别与VL硫酸反应放出的H2一样多时,__________。
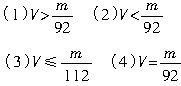
首先分析出mg钠、铝、铁分别与2mol/L的硫酸完全反应时所消耗酸的体积V为:
Na完全反应时:2Na +H2SO4 = Na2SO4 +H2↑
46g 1mol
m 2mol/L×VL
解得:V1= m/92
AL完全反应时:2AL+3H2SO4=AL2(SO4)3+3H2↑
54g 3mol
m 2mol/L×VL
解得:V2 = m/36
Fe完全反应时:Fe +H2SO4 = FeSO4 +H2↑
56g 1mol
m 2mol/L×VL
解得:V3 = m/112
用数轴法表示V1、V2、V3:
——V3——V1——V2——> V(硫酸的体积)
m/112 m/92 m/36
(1)当V﹤m/112时,Fe、AL、Na都过量,Na再与水反应放出H2,Na放H2最多,Fe、AL一样多。
(2)当V =m/112时,Fe完全反应,AL、Na过量,Na再与水反应放出H2,Na放H2最多,Fe、AL一样多。
(3)m/112﹤V﹤m/92时,Fe不足;AL、Na过量;Na再与水反应放出H2,所以V(Na)﹥V(AL)﹥V(Fe)。
(4)V=m/92时,Fe不足;Na完全反应;AL过量,所以V(Na)=V(AL)﹥V(Fe)。
(5)V﹥m/92时,Fe不足;Na不足;AL继续与酸反应产生H2,所以V(AL)﹥V(Na)﹥V(Fe)。

练习册系列答案
相关题目