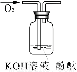题目内容
某溶液中存在较多的H+、SO42-、NO3-,则该溶液中还可能大量存在的离子组是
A.Mg2+、NH4+、Cl- B.Mg2+、Ba2+、Br-
C.Na+、Cl-、I- D.Al3+、HCO3-、Cl-
A
【解析】
试题分析:A中的离子可以和溶液中的H+、SO42-、NO3-共存;B中Ba2+溶液中SO42-形成沉淀;C中Cl-、I-会被溶液中的硝酸氧化;D中的HCO3-和溶液中的H+反应,不能共存。
考点:离子共存

 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案下列离子可以大量共存的是( )
A.K +、SO42-、OH-、AlO2- B.K + 、Ag+ 、Cl-、NO3-
C.Ba2+ 、Na+ 、OH-、CO32- D.Na+、NH4+ 、NO3-、OH-
实验目的:探究过氧化钠与水反应后的溶液滴加酚酞试液先变红后退色的原因。
[分析与猜想]
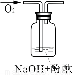
(1)根据过氧化钠与水反应的原理:2Na2O2 + 2H2O = 4NaOH + O2↑,往过氧化钠固体完全溶解反应后的溶液中滴加酚酞本应只会变红而不会退色,而实验中发现酚酞变红后又退色。由此提出如下的猜想:
A.氧气有漂白性
B.氢氧化钠有漂白性
C.
[实验与判断] 请完成下列表格:
实验编号 | 1 | 2 | 3 |
实验装置 | | | |
验证猜想 |
| C |
|
实验现象 | 溶液变红后不退色 | ||
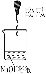
实验说明 | 1、2的实验中NaOH溶液是用 (填“氢氧化钠固体”、“氧化钠固体”、“过氧化钠固体”)溶于水配制的。 | ||
(2)根据以上实验分析发现:过氧化钠与水反应过程中,钠元素形成了稳定的化合物,溶液中还生成了一种不很稳定、具有漂白性的物质X,X的化学式是 。
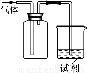
(3)可用右图装置对溶液中不很稳定的物质进行探究,在①处装入的物质是 (填选项,下同),②处装入的物质是 。
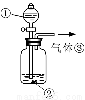
A.酚酞试剂 B.过氧化钠与水反应后的溶液
C.二氧化锰 D.氢氧化钠固体配制的溶液
(4)气体③是 ,过氧化钠与水反应的化学方程式没有写出X来,原因是 。