题目内容
【题目】烟气(主要成分CO2、CO、SO2、NOX) 的排放对环境有很大的影响。
I.利用氨水作吸收液是当前有效捕捉CO2的方法,经过可逆反应生成NH4HCO3。生成的NH4HCO3分解可得到CO2,从而实现吸收液的再生。
(1)写出氨水捕捉CO2 的化学方程式 。
(2)已知:NH4HCO3 溶液显碱性,下列说法不正确的是 。
a.c(NH3·H2O)>c(H2CO3)
b.c(NH4+)>c(HCO3—)>c(OH—)>c(H+)
c.c(NH3·H2O)+c(NH4+)=c(H2CO3)+c(HCO3—)
d.c(HCO3—)+2c(CO32—)+c(OH—)=c(H+)+c(NH4+)
(3)如图是氨水吸收CO2 的脱除率随温度变化的关系图。
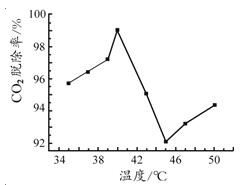
应用平衡移动原理分析 CO2 在 40℃-45℃ 脱除率降低可能的原因 。
II.SO2、NOX 可以经 O3 预处理后用 CaSO3 水悬浮液吸收,可减少烟气中SO2、NOX 的含量。O3 氧化烟气中 NOX 的主要反应的热化学方程式为:
(4)用CaSO3水悬浮液吸收烟气中NO2时,清液 ( pH约为8) 中SO32-将NO2转化为NO2-,其离子方程式为 。
(5)CaSO3水悬浮液中加入Na2SO4溶液能提高NO2 的吸收速率,用平衡移动原理解释其主要原因是 。
【答案】(1)CO2+NH3·H2O![]() NH4HCO3(2分)(2)ac(2分)
NH4HCO3(2分)(2)ac(2分)
(3)氨水吸收CO2为放热反应,在40~45℃升高温度平衡向左移动,使CO2脱除率降低。(其它合理答案均给分)(2分)
(4)SO32-+2NO2+2OH-=SO42-+2NO2-+H2O(2分)
(5)CaSO3(s)![]() Ca2+(aq)+SO32-(aq),加入Na2SO4溶液,SO42-结合Ca2+,c(Ca2+)降低,使上述平衡向右移动,c(SO32-)增大,提高NO2的吸收速率(2分)
Ca2+(aq)+SO32-(aq),加入Na2SO4溶液,SO42-结合Ca2+,c(Ca2+)降低,使上述平衡向右移动,c(SO32-)增大,提高NO2的吸收速率(2分)
【解析】
试题分析: I.(1)氨水捕捉 CO2 的化学方程式CO2 + NH3·H2O![]() NH4HCO3;
NH4HCO3;
(2)a、越弱越水解,谁强显谁性,NH4HCO3 溶液显碱性,说明HCO3-水解程度大于NH4+,所以c(NH3·H2O)<c(H2CO3),a错误;b、NH4HCO3 溶液显碱性,说明HCO3-水解程度大于NH4+,所以c(NH4+)> c(HCO3-)>c(OH-)>c(H+),b正确;c、根据物料守恒c (NH3·H2O) + c(NH4+)= c(H2CO3)+ c(HCO3-)+ c (CO32-),c错误;d、根据电荷守恒c(HCO3-)+2c(CO32-)+ c(OH-)=c(H+)+c(NH4+),d正确;答案选ac;
(3)氨水吸收CO 2为放热反应,在40~45℃升高温度平衡向左移动,使CO2 脱除率降低。
(4)NO2被还原为NO2-,则SO32-被氧化为SO42-,其离子方程式为SO32-+2NO2+2OH- =SO42-+2NO2-+H2O;
(5)亚硫酸钙存在溶解平衡:CaSO3(s)![]() Ca2+(aq)+ SO32-(aq),加入Na2SO4溶液,SO42-结合Ca2+,使 c(Ca2+)降低,使上述平衡向右移动,c(SO32-)增大,提高NO2的吸收速率。
Ca2+(aq)+ SO32-(aq),加入Na2SO4溶液,SO42-结合Ca2+,使 c(Ca2+)降低,使上述平衡向右移动,c(SO32-)增大,提高NO2的吸收速率。

 备战中考寒假系列答案
备战中考寒假系列答案【题目】卤族元素的单质能与H2反应
H2+F2=2HF | 在暗处能剧烈化合并发生爆炸 |
H2+Cl2=2HCl | 光照或点燃发生反应 |
H2+Br2=2HBr | 加热至一定温度才能反应 |
H2+I2=2HI | 不断加热才能缓慢反应,生成的HI会分解 |
(1)卤族元素位于周期表中的______________族。
(2)用电子式表示HCl的形成过程______________。
(3)依据上表,可以推测出:随着原子序数的递增,___________(填字母)。
a. 单质的熔沸点逐渐升高 b. 元素的非金属性逐渐减弱
c. 卤化氢的还原性依次减弱 d. 卤化氢的稳定性依次减弱
(4)不同卤素原子之间可形成卤素互化物,其性质与卤素单质相近。写出BrCl和SO2在水溶液中发生反应的化学方程式___________。

