��Ŀ����
����Ŀ������β���е�NOx�Ǵ�����Ⱦ��֮һ����CH4����ԭNOx�������������������Ⱦ��
��1����֪��
��CH4(g)��4NO2(g)![]() 4NO(g)��CO2(g)��2H2O(g) ��H1=-574kJ��mol-1
4NO(g)��CO2(g)��2H2O(g) ��H1=-574kJ��mol-1
��CH4(g)��4NO(g)![]() 2N2(g)��CO2(g)��2H2O(g) ��H2=-1160kJ��mol-1
2N2(g)��CO2(g)��2H2O(g) ��H2=-1160kJ��mol-1
��CH4(g)��2NO2(g)![]() N2(g)��CO2(g)��2H2O(g) ��H3�� ��
N2(g)��CO2(g)��2H2O(g) ��H3�� ��
��2����Ӧ��������ѧ�����ƺܴ���ԭ���� ���ڹ̶������а�һ���������CH4��NO2�����NO2ת���ʵķ�Ӧ������ ��
��3����130���180��ʱ���ֱ�0.50mol CH4��a mol NO2����1L���ܱ������з�����Ӧ��������й��������±���
ʵ���� | �¶� | 0���� | 10���� | 20���� | 40���� | 50���� | |
1 | 130�� | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
2 | 180�� | n(CH4)/mol | 0.50 | 0.30 | 0.18 | 0.15 |
�� ��չʵ��1��ʵ��2��Ŀ���� ��
�� 130��ʱ����Ӧ��20����ʱ��NO2�ķ�Ӧ������ ��
�� 180��ʱ�ﵽƽ��״̬ʱ��CH4��ƽ��ת����Ϊ ��
�� ��֪130��ʱ�÷�Ӧ�Ļ�ѧƽ�ⳣ��Ϊ6.4���Լ���a= ��
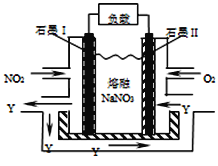
��4��NO2��O2������NaNO3������ȼ�ϵ�أ���ԭ����ͼ���õ����ʹ�ù�����ʯīI�缫������������Y���õ缫��ӦΪ ��
���𰸡���1��-867kJ��mol-1
��2������Ӧ����������ʮ�����������¶ȡ�����ѹǿ
��3�����о��¶ȶԸû�ѧƽ���Ӱ��
��0.025mol/(L��min)��70%��1.2
��4��NO2+NO3--e-�TN2O5
��������
�����������1�����ݸ�˹���ɣ���![]() ����
����![]() �ã�CH4(g) �� 2NO2(g)
�ã�CH4(g) �� 2NO2(g)![]() N2(g) �� CO2(g) �� 2H2O(g) ��H3��-867 kJ��mol-1����2������Ӧ����������ʮ������������Ӧ�����ƺܴ����ڹ̶������а�һ���������CH4��NO2����Ӧ���ȣ������¶�ƽ�������ƶ�NO2ת��������Сѹǿ��ƽ�������ƶ���NO2ת������������3����ʵ��1��ʵ��2ֻ���¶Ȳ�ͬ����չʵ��1��ʵ��2��Ŀ�����о��¶ȶԸû�ѧƽ���Ӱ������ 130��ʱ����Ӧ��20����ʱ��NO2�ķ�Ӧ������
N2(g) �� CO2(g) �� 2H2O(g) ��H3��-867 kJ��mol-1����2������Ӧ����������ʮ������������Ӧ�����ƺܴ����ڹ̶������а�һ���������CH4��NO2����Ӧ���ȣ������¶�ƽ�������ƶ�NO2ת��������Сѹǿ��ƽ�������ƶ���NO2ת������������3����ʵ��1��ʵ��2ֻ���¶Ȳ�ͬ����չʵ��1��ʵ��2��Ŀ�����о��¶ȶԸû�ѧƽ���Ӱ������ 130��ʱ����Ӧ��20����ʱ��NO2�ķ�Ӧ������![]() 0.025mol/(L��min)���� 180��ʱ�ﵽƽ��״̬ʱ��CH4�����ʵ���Ϊ0.15mol��ƽ��ת����Ϊ
0.025mol/(L��min)���� 180��ʱ�ﵽƽ��״̬ʱ��CH4�����ʵ���Ϊ0.15mol��ƽ��ת����Ϊ![]() 70%
70%


a= 1.2mol
��4������װ��ͼ��ʯīI�缫�Ǹ�����ʧ���ӷ���������Ӧ����Ԫ�ػ��ϼ�����Ϊ+5,ʯīI�缫������������Y,Y��N2O5���缫��Ӧ��NO2 + NO3- -e- �T N2O5��



