题目内容
【题目】常温下,![]() 某一元碱
某一元碱![]() 与
与![]() 盐酸反应,反应过程中由水电离的
盐酸反应,反应过程中由水电离的![]() 浓度的负对数
浓度的负对数![]() 与所加盐酸的体积间关系如图,下列说法正确的是( )
与所加盐酸的体积间关系如图,下列说法正确的是( )
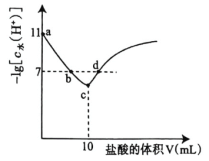
A.水的电离程度![]()
B.![]() 点溶液满足
点溶液满足![]()
C.![]() 为弱碱,其电离平衡常数
为弱碱,其电离平衡常数![]() 约为
约为![]()
D.![]() 点溶液满足
点溶液满足![]()
【答案】A
【解析】
图中c点![]() 最小推出c点为恰好完全反应点,
最小推出c点为恰好完全反应点,![]() <7说明
<7说明![]() 发生盐的水解,说明BOH为弱碱;以a点溶质全部是BOH,来计算
发生盐的水解,说明BOH为弱碱;以a点溶质全部是BOH,来计算![]() 值。
值。
A.a点溶质是BOH,为碱性溶液,抑制水的电离,b、d点的pH=7,为中性溶液,c点是盐酸与BOH恰好完全反应的点,得到BCl盐溶液,呈酸性,![]() 的水解促进水的电离,故水的电离程度c>d=b>a,A正确;
的水解促进水的电离,故水的电离程度c>d=b>a,A正确;
B. c点溶质为BCl,由质子守恒可得:![]() ,d点HCl过量,则
,d点HCl过量,则![]() ,B错误;
,B错误;
C.a点加入盐酸的量为0,溶液溶质为BOH,由此可知常温下BOH电离的![]() ,
,![]() ,则BOH为弱碱,且
,则BOH为弱碱,且![]() 的数量级为
的数量级为![]() ,C错误;
,C错误;
D.c点![]() 最小,c点HCl与BOH恰好完全反应得BCl溶液,
最小,c点HCl与BOH恰好完全反应得BCl溶液,![]() ,根据物料守恒:
,根据物料守恒:![]() ,D错误;
,D错误;
答案选A。

练习册系列答案
相关题目
【题目】在10 L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g) ![]() M(g)+N(g),所得实验数据如下表:
M(g)+N(g),所得实验数据如下表:
实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | ||
n(X) | n(Y) | n(M) | |||
① | 700 | 0.40 | 0.10 | 0.090 | |
② | 800 | 0.10 | 0.40 | 0.080 | |
③ | 800 | 0.20 | 0.30 | a | |
④ | 900 | 0.10 | 0.15 | b | |
下列说法正确的是( )
A. 实验①中,若5 min时测得n(M)=0.050 mol,则0至5 min时间内,用N表示的平均反应速率v(N)=1.0×10-2 mol·L-1·min-1
B. 实验②中,该反应的平衡常数K=2.0
C. 实验③中,达到平衡时,X的转化率为60%
D. 实验④中,达到平衡时,b>0.060