题目内容
固体粉末X中可能含有Fe、Fe2O3、K2SiO3、K2SO3、KAlO2、MgCl2、K2CO3中的若干种。为确定该固体粉末的成分,现取X进行连续实验,实验过程及产物如下:
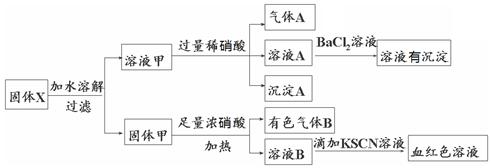
根据上述实验,以下说法正确的是

根据上述实验,以下说法正确的是
| A.气体A一定只是NO |
| B.由于在溶液A中加入BaCl2溶液有沉淀产生,因此可以判断溶液甲中含有K2SO3 |
| C.若向固体甲中加入足量浓盐酸,再加KSCN溶液,没有血红色,则证明原混合物中一定没有Fe2O3 |
| D.溶液甲中一定含有K2SiO3、可能含有KAlO2、MgCl2 |
B
试题分析:A项,溶液甲中可能含有K2CO3,当其与稀硝酸反应时,可生成CO2气体,故A错误;B项,溶液A中加入BaCl2溶液有沉淀产生,说明溶液A中含量有SO42-,则溶液甲中必含有K2SO3,当甲与稀硝酸反应时SO32-被氧化为SO42-,故B正确;C项,当固体粉末X中含有足量的Fe时,Fe3+可以被还原为Fe2+,加入KSCN溶液时,不会出现血红色,故C错误;D项,溶液甲中加过量稀硝酸,生成沉淀A,说明溶液甲中一定含有K2SiO3,由于Mg2+与SiO32-不能共存,所以溶液甲中一定没有MgCl2,故D错误。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
