题目内容
【题目】氯元素在自然界有35Cl和37Cl两种同位素,氯元素的相对原子质量为35.5,则35Cl和37Cl的原子个数比为____;由Na、35Cl和37C构成的11.7g氯化钠中含35Cl的质量是___g;11.7g该晶体刚好能和某200mL的AgNO3溶液完全反应,则该AgNO3溶液的物质的量浓度是___mol/L。
【答案】3∶1 5.25 1
【解析】
根据元素的相对原子质量列式计算35Cl和37Cl的原子个数比,再结合氯化钠的质量计算35Cl的质量,根据氯化钠与硝酸银的化学方程式计算AgNO3溶液的物质的量浓度。
(1)设1737Cl和1735Cl的物质的量分别为xmol、ymol,则有:![]() =35.5,解之得x∶y=3∶1;n(NaCl)=
=35.5,解之得x∶y=3∶1;n(NaCl)=![]() =0.2mol,所以1735Cl为0.15mol,1735Cl的质量是0.15mol×35g/mol=5.25g;根据NaCl~AgNO3~AgCl知,n(AgNO3)= n(NaCl)=0.2mol,c(AgNO3)=
=0.2mol,所以1735Cl为0.15mol,1735Cl的质量是0.15mol×35g/mol=5.25g;根据NaCl~AgNO3~AgCl知,n(AgNO3)= n(NaCl)=0.2mol,c(AgNO3)=![]() =1mol/L,故答案为:3∶1;5.25;1。
=1mol/L,故答案为:3∶1;5.25;1。

 活力课时同步练习册系列答案
活力课时同步练习册系列答案【题目】如表中物质间的转化能按如图所示通过一步反应进行的是( )
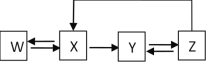
选项物质 | W | X | Y | Z |
A | Ca | CaO | Ca(OH)2 | CaCO3 |
B | S | SO3 | H2SO4 | CaSO4 |
C | Si | SiO2 | Na2SiO3 | H2SiO3 |
D | Fe | Fe2O3 | FeCl3 | Fe(OH)3 |
A.AB.BC.CD.D
【题目】下列实验对应现象及结论有错误的是( )
选项 | 实验 | 现象 | 结论 |
A | 向AgCl悬浊液中加入KI溶液,振荡 | 沉淀由白色变为黄色 | AgCl溶解度大于AgI |
B | 向2mL0.1mol/L的FeCl3溶液中加足量铁粉,振荡,加1滴KSCN溶液 | 黄色逐渐消失,加KSCN溶液颜色不变 | 还原性:Fe>Fe2+ |
C | 常温下,向等体积、等浓度的NaHCO3和CH3COONa溶液中分别滴加2滴酚酞 | 两份溶液均变红,NaHCO3溶液红色更深 | 常温下的水解平衡常数: Kh(CH3COO-)<Kh(HCO3-) |
D | 常温时,用两支试管各取4mL 0.1mol/L 酸性KMnO4溶液,分别加入0.1mol/L和0.2 mol/L H2C2O4溶液各2 mL | 两试管溶液均褪色,且加0.2mol/L H2C2O4 溶液的试管中褪色更快 | 其它条件不变,H2C2O4溶液的浓度越大,化学反应速率越大 |
A. AB. BC. CD. D
