题目内容
【题目】已知
Fe(s)+CO2(g)![]() FeO(s)+CO(g) K1 ①
FeO(s)+CO(g) K1 ①
Fe(s)+H2O(g)![]() FeO(s)+H2(g) K2 ②
FeO(s)+H2(g) K2 ②
H2(g)+CO2(g)![]() H2O(g)+CO(g)K3 ③
H2O(g)+CO(g)K3 ③
又已知不同温度下,K1、K2值如右表:
温度/℃ | K1 | K2 |
500 | 1.00 | 3.15 |
700 | 1.47 | 2.26 |
900 | 2.40 | 1.60 |
(1)判断反应③达到化学平衡状态的依据是____________。
a.混合气体的平均摩尔质量不变
b.混合气体中c(CO)不变
c.v(H2O)正=v(H2)逆
d.断裂2 mol H—O键的同时生成1 mol H—H键
(2)若500 ℃时进行反应①,CO2起始浓度为2 mol·L-1,2分钟后建立平衡,则CO2转化率为________,用CO表示的速率为________________。
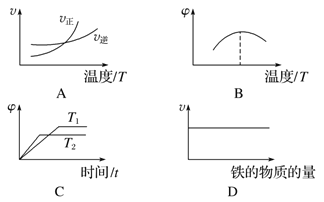
(3)下列图象不符合反应②的是___________(填序号)(图中v是速率,φ为混合物中H2的体积百分含量)。
(4)900 ℃进行反应③,其平衡常数K3为____________(求具体数值),焓变ΔH__________0(填“>”“=”或“<”),理由是 。
【答案】(1)bc(2)50%;0.5 mol·L-1·min-1(3)A
(4)1.50;>;500℃时K3=1/3.15,900℃K3=1.5,说明温度升高,平衡正向移动,K增大,正反应是吸热反应。或温度升高,K1增大,K减小,则△H1>0,则△H2<0,△H3= △H1-△H2>0。
【解析】试题分析:(1)a.由方程式可知反应③反应前后混合气体的总质量和总物质的量不变,所以平均摩尔质量不变不能作为判断达到平衡的依据,故a不正确;b.混合气体中c(CO)不变说明正逆反应速率相等,该反应已经达到了化学平衡状态,故B正确;c.该反应中水与氢气的化学计量数相等,所以v(H2O)正=v(H2)逆说明正逆反应速率相等,该反应已经达到了化学平衡状态,故c正确;d.根据化学方程式可知,断裂2 mol H-O键的同时一定生成1 mol H-H键,与化学平衡无关,故D错误。故答案为:bc;
(2)反应Fe(s)+CO2(g)═FeO(s)+CO(g)的平衡常数k=c(CO)/c(CO2)=1,由表中数据可知,对于反应①,令平衡时参加反应的二氧化碳的物质的量浓度减小为xmol/L,则:
Fe(s)+CO2(g)═FeO(s)+CO(g)
c开始(mol/L): 2 0
c变化(mol/L): x x
c平衡(mol/L): 2-x x
所以x/(2-x)=1,解得x=1,故二氧化碳的转化率为1mol/L÷2mol/L×100%=50%;
CO表示的平均速率v(CO)= 2mol/L÷2min=1mol/(Lmin)。
故答案为:50%;1mol/(Lmin);
(3)A.由图可知,升高温度,平衡向正反应移动,故图象表示正反应吸热反应,反应②正反应是放热反应,图象与实际不相符合,故A选;B.由图可知,最高点到达平衡,温度升高,混合物中氢气的含量降低,平衡向逆反应进行,故图象表示正反应为放热反应,反应②正反应是放热反应,图象与实际相符,故B不选;C.由图可知,温度T2先到达平衡,故温度T2>T1,随温度升高达到平衡时,混合物中氢气的含量降低,平衡向逆反应进行,故图象表示正反应为放热反应,反应①正反应是放热反应,图象与实际相符,故C不选;D.由于铁为固体,其他条件不变时,增加铁的量化学反应速率基本不变,故D不选。
故答案为:A;
(4)根据勒夏特列原理可知,化学反应①-②=③,所以900℃时,K3=K1/K2=2.4÷1.6=1.5。500℃时K3=1/3.15,900℃K3=1.5,说明温度升高,平衡正向移动,K增大,正反应是吸热反应,即900℃时,△H>0。或温度升高,K1增大,K2减小,则△H1>0,则△H2<0,△H3= △H1-△H2>0。故答案为:1.50;>;500℃时K3=1/3.15,900℃K3=1.5,说明温度升高,平衡正向移动,K增大,正反应是吸热反应。或温度升高,K1增大,K减小,则△H1>0,则△H2<0,△H3= △H1-△H2>0。

 阶梯计算系列答案
阶梯计算系列答案【题目】甲、乙、丙、丁四种物质的相互反应关系如图所示(“—”表示相连的物质间能发生反应)下列符合对应反应关系的选项是
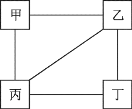
选项 | A | B | C | D | |
物质 | 甲 | Ca(OH2 | CO2 | H2 | Fe |
乙 | Na2CO3 | NaOH | O2 | HCl | |
丙 | H2SO4 | CaCl2 | CuO | CuSO4 | |
丁 | BaCl2 | AgNO3 | HCl | NaOH | |
【题目】
(1)计算结果:需要称取NaOH固体 g;
(2)配制时,必须使用的上述仪器有 (填代号);
(3)配制时,其正确的操作顺序是(数字序号表示,每个操作只用一次) ;
① 用少量水洗涤烧杯2 ~ 3次,洗涤液均注入容量瓶,振荡
② 在盛有NaOH固体的烧杯中加入适量水溶解
③ 将烧杯中已冷却的溶液沿玻璃棒注入容量瓶中
④ 将容量瓶盖紧,反复上下颠倒,摇匀
⑤ 改用胶头滴管加水,使溶液凹面恰好与刻度相切
⑥ 继续往容量瓶内小心加水,直到液面接近刻度1 ~ 2cm处
(4)若出现如下情况,其中将引起所配溶液浓度偏高的是 (填下列编号)。
①容量瓶实验前用蒸馏水洗干净,但未烘干 ②定容观察液面时俯视
③溶解过程中物质放热,没有等至室温配置 ④加蒸馏水时不慎超过了刻度
(5)容量瓶不能用于__________(填下列序号)。
① 配制一定体积准确浓度的标准溶液
② 贮存溶液
③ 测量容量瓶规格以下的任意体积的液体
④ 准确稀释某一浓度的溶液
⑤ 用来加热溶解固体溶质
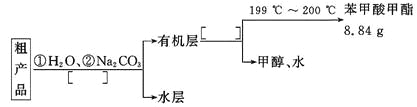
II.(共6分)某化学小组以苯甲酸为原料,制取苯甲酸甲酯,已知有关物质的沸点如下表:
物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
沸点/℃ | 64.7 | 249 | 199.6 |
(1)甲和乙两位同学分别设计了如下图所示的两套实验室合成苯甲酸甲酯的装置(夹持仪器和加热仪器均已略去)。根据有机物的沸点,最好采用______(填“甲”或“乙”)装置。理由是 。
(2)实验中浓硫酸的作用是________________。
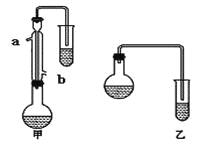
(3)反应物CH3OH应过量,理由是 。
(4)苯甲酸甲酯粗产品中往往含有少量甲醇、苯甲酸和水等,现拟用下列流程图进行精制,请在流程图中方括号内填入操作方法的名称。