题目内容
某温度下,向pH=6的蒸馏水中,加入NaHSO4晶体,保持温度不变,测得溶液的pH为2 ,下列对该溶液的叙述中不正确的是
| A.该温度下加入等体积pH=12的NaOH溶液可使该溶液恰好呈中性 |
| B.由水电离出来的H+的浓度是1.0×10-10mol/L |
| C.加入NaHSO4晶体抑制了水的电离 |
| D.该温度高于25℃ |
A
解析试题分析:A、纯水的pH=6,说明c(H+)=c(OH-)=1×10-6mol?L-1,Kw=1×10-12,应加入等体积浓度为0.01mol?L-1的氢氧化钠溶液,故应加入等体积pH=10的NaOH溶液,可使该溶液恰好呈中性,故A不正确; B、水电离出来的氢离子的浓度等于溶液中氢氧根的浓度,c(H+)=c(OH-)= =10-12÷0.01=1×10-10mol?L-1,故B正确;C、NaHSO4晶体电离生成氢离子,相当于一元强酸,抑制了水的电离,故C正确;D、纯水的pH=6,说明c(H+)=c(OH-)=1×10-6mol?L-1,Kw=1×10-12>1×10-14,说明温度高于25℃,故D正确,故答案选A。
=10-12÷0.01=1×10-10mol?L-1,故B正确;C、NaHSO4晶体电离生成氢离子,相当于一元强酸,抑制了水的电离,故C正确;D、纯水的pH=6,说明c(H+)=c(OH-)=1×10-6mol?L-1,Kw=1×10-12>1×10-14,说明温度高于25℃,故D正确,故答案选A。
考点:考查水的电离;pH的简单计算

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案室温下,用0.100 0 mol·L-1NaOH溶液分别滴定体积均为20.00 mL的盐酸和醋酸溶液,滴定曲线如右图。下列说法正确的是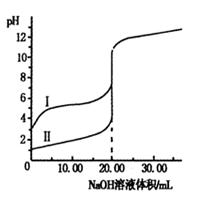
| A.I、Ⅱ分别表示盐酸和醋酸的滴定曲线 |
| B.盐酸和醋酸的浓度均为0.100 0 mol·L-1 |
| C.pH=7时,两种酸所消耗NaOH溶液的体积相等 |
| D.V(NaOH)=20.00mL时,c(Cl一)=c(CH3COO一) |
下列叙述不正确的是
| A.在稀盐酸中c(H+)=c(Cl-)+c(OH-) |
| B.常温下,在0.1mol/L的硫酸铵溶液中由水电离出的c(OH-)>10-7mol/L |
| C.如果Na2A的水溶液显中性,该溶液中一定没有电离平衡 |
| D.热水中加入硫酸钠溶解至饱和,此时溶液的pH小于7 |
0.1mol·L-1HF溶液的pH=2,则该溶液中有关浓度关系式不正确的是( )
| A.c(H+)>c(F-) | B.c(H+)>c(HF) |
| C.c(OH-)<c(HF) | D.c(HF)>c(F-) |
下列离子方程式中,属于水解反应的是( )
A.HCOOH+H2O HCOO-+H3O+ HCOO-+H3O+ |
B.CO2+H2O HCO3-+H+ HCO3-+H+ |
C.CO32-+H2O HCO3-+OH- HCO3-+OH- |
D.HS-+H2O S2-+H3O+ S2-+H3O+ |
25 ℃时,在等体积的①pH=0的硫酸溶液、②0.05 mol/L的Ba(OH)2溶液、③pH=10的Na2S溶液、④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是( )
| A.1∶10∶1010∶109 | B.1∶5∶5×109∶5×108 |
| C.1∶20∶1010∶109 | D.1∶10∶104∶109 |
已知下面三个数据:7.2×10-4、4.6×10-4、4.9×10-10分别是三种酸的电离平衡常数,若已知这些酸可发生如下反应:
①NaCN+HNO2=HCN+NaNO2,
②NaCN+HF=HCN+NaF,
③NaNO2+HF=HNO2+NaF。
由此可判断下列叙述中,不正确的是( )
| A.HF的电离平衡常数为7.2×10-4 |
| B.HNO2的电离平衡常数为4.9×10-10 |
| C.根据①③两个反应即可知三种酸的相对强弱 |
| D.HNO2的电离平衡常数比HCN大,比HF小 |
对H2O的电离平衡不产生影响的微粒是( )。
A. | B.26M3+ | C. | D. |
50℃时,下列各溶液中,离子的物质的量浓度关系正确的是( )
| A.pH=4的醋酸中:c(H+)=4.0 mol·L-1 |
| B.饱和小苏打溶液中:c(Na+)=c(HCO3—) |
| C.饱和食盐水中:c(Na+)+c(H+)=c(Cl-)+c(OH-) |
| D.pH=12的纯碱溶液中:c(OH-)=1.0×10-2 mol·L-1 |