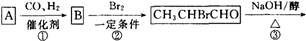
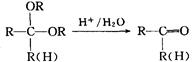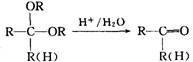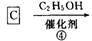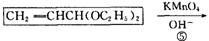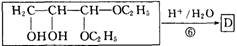题目内容
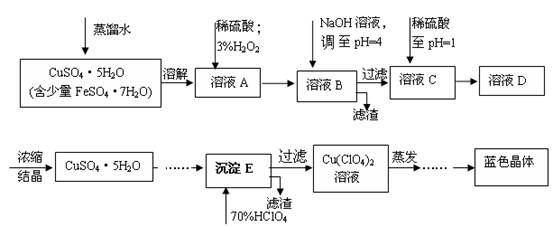
(本题共12分)六水合高氯酸铜 [Cu(C1O4)2 ·6H2O]是一种蓝色晶体,易溶于水,120℃时开始分解。实验室用硫酸铜的粗产品制备少量高氯酸铜晶体的流程如下:
已知:
|
离子 |
溶液pH值 |
|
|
开始沉淀 |
沉淀完全 |
|
|
Fe2+ |
7.6 |
9.6 |
|
Fe3+ |
2.7 |
3.7 |
|
Cu2+ |
5.2 |
6.4 |
(1).写出A→B过程中发生反应的离子方程式为 。
(2).溶液C中加入稀硫酸调至pH=1的目的是________________________________________。
(3).如欲检验溶液C中的杂质是否除净,其操作是 。
(4).蒸发至__________(填写现象),然后经过冷却结晶、过滤、洗涤、 (填写操作),得到纯净的蓝色晶体。
(5).为了测定硫酸铜的粗产品的纯度,某同学称量硫酸铜的粗产品2.000g、 、 、(填写实验步骤)过滤、洗涤沉淀、在空气中灼烧,至质量不再改变时,称得质量为0.58816 g。
(6).该样品的纯度为___________。如果样品的实际纯度为93.2%,则测定的相对误差为__________。
(1).2Fe2++2H++H2O2→2Fe3++2H2O (2分)
(2).防止硫酸铜溶液在蒸发浓缩过程中Cu2+发生水解而得不到纯净的晶体 (2分)
(3).取少量溶液,加入KSCN溶液(NH4SCN溶液),观察溶液是否仍然为蓝色。(2分)
(4).有晶膜出现 低温烘干 (或自然干燥) (2分)
(5).加水溶解 、加入过量NaOH(aq) (共2分,各1分)
(6).91.9% -1.4%(或-1.39%) (共2分,各1分)
【解析】(1).加入双氧水的目的是氧化亚铁离子,方程式为2Fe2++2H++H2O2→2Fe3++2H2O。
(2).由于铜离子水解显酸性,所以加入稀硫酸可防止硫酸铜溶液在蒸发浓缩过程中Cu2+发生水解而得不到纯净的晶体。
(3)如果杂质没有除净,则滤液中一定含有铁离子,所以用KSCN溶液检验即可。
(4).当蒸发有晶膜出现时,即应停止加热。洗涤之后必须烘干。
(5).要检验纯度,需要通过沉淀法将铜离子转化为氢氧化铜沉淀,所以操作是加水溶解、然后加入过量NaOH(aq)即可生成氢氧化铜沉淀。
(6)最后得到的物质是氧化铜,所以根据铜原子守恒可知,硫酸铜晶体的质量是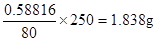 ,所以纯度是1.8385÷2×100%=91.9%,所以相对误差是(91.9%-93.2%)÷93.2%×100%=-1.4%。
,所以纯度是1.8385÷2×100%=91.9%,所以相对误差是(91.9%-93.2%)÷93.2%×100%=-1.4%。

 名校课堂系列答案
名校课堂系列答案(本题共12分)六水合高氯酸铜 [Cu(C1O4)2 ·6H2O]是一种蓝色晶体,易溶于水,120℃时开始分解。实验室用硫酸铜的粗产品制备少量高氯酸铜晶体的流程如下: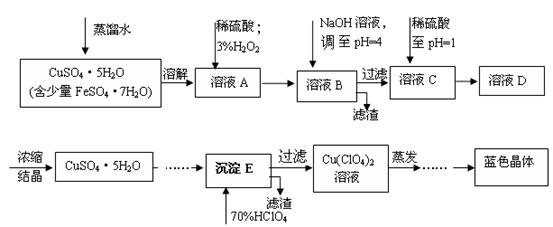
已知:
| 离子 | 溶液pH值 | |
| 开始沉淀 | 沉淀完全 | |
| Fe2+ | 7.6 | 9.6 |
| Fe3+ | 2.7 | 3.7 |
| Cu2+ | 5.2 | 6.4 |
(2).溶液C中加入稀硫酸调至pH=1的目的是________________________________________。
(3).如欲检验溶液C中的杂质是否除净,其操作是 。
(4).蒸发至__________(填写现象),然后经过冷却结晶、过滤、洗涤、 (填写操作),得到纯净的蓝色晶体。
(5).为了测定硫酸铜的粗产品的纯度,某同学称量硫酸铜的粗产品2.000g、 、 、(填写实验步骤)过滤、洗涤沉淀、在空气中灼烧,至质量不再改变时,称得质量为0.58816 g。
(6).该样品的纯度为___________。如果样品的实际纯度为93.2%,则测定的相对误差为__________。