题目内容
下列的图示与对应的叙述相符的是( )
A、图 表示KNO3的溶解度曲线,图中a点表示的溶液通过升温可以得到b点 |
B、图 表示某一放热反应,若使用催化剂E1、E2、△H都会发生改变 |
C、图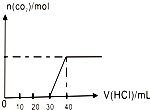 表示向Na2CO3和NaHCO3的混合溶液中滴加稀盐酸时,产生CO2的情况 |
D、图 表示向100mL 0.1mol/L的AlCl3和0.1mol/L的NH4Cl混合溶液中滴加1mol/L的NaOH溶液时n(Al3+)和n(AlO2-)的变化情况 |
考点:溶解度、饱和溶液的概念,离子方程式的有关计算,反应热和焓变
专题:图示题
分析:A.a点为不饱和溶液,通过升高温度可以蒸发溶剂,使溶液变成饱和溶液;
B.催化剂可以降低反应需要能量,但是不会影响反应的焓变;
C.当溶质为碳酸钠溶液时,根据反应CO32-+H+═HCO3-、HCO3-+H+═CO2↑+H2O可知,生成二氧化碳气体前消耗的盐酸与生成二氧化碳消耗的盐酸的体积相等,由于含有碳酸氢钠,则生成二氧化碳消耗的盐酸大于明确生成二氧化碳消耗的盐酸;
D.铝离子先与氢氧根离子反应生成氢氧化铝,氢氧化铝与氢氧化钠反应前,铵根离子优先与氢氧根离子反应,铵根离子消耗完全后氢氧化铝与氢氧化钠开始反应,偏铝酸根离子逐渐增多,据此进行判断.
B.催化剂可以降低反应需要能量,但是不会影响反应的焓变;
C.当溶质为碳酸钠溶液时,根据反应CO32-+H+═HCO3-、HCO3-+H+═CO2↑+H2O可知,生成二氧化碳气体前消耗的盐酸与生成二氧化碳消耗的盐酸的体积相等,由于含有碳酸氢钠,则生成二氧化碳消耗的盐酸大于明确生成二氧化碳消耗的盐酸;
D.铝离子先与氢氧根离子反应生成氢氧化铝,氢氧化铝与氢氧化钠反应前,铵根离子优先与氢氧根离子反应,铵根离子消耗完全后氢氧化铝与氢氧化钠开始反应,偏铝酸根离子逐渐增多,据此进行判断.
解答:
解:A.b点为硝酸钾在80℃时的饱和溶液,a点为不饱和溶液,可以通过升高温度蒸发掉部分溶剂,然后恢复到80℃可以变成饱和溶液,故A正确;
B.使用催化剂可以改变反应需要能量,但是根据盖斯定律可知,反应热与反应途径无关,所以使用催化剂不会改变反应的焓变,故B错误;
C.图象中没有生成二氧化碳时消耗了30mL的盐酸,生成二氧化碳只消耗了10mL体积的盐酸,根据反应的离子方程式CO32-+H+═HCO3-、HCO3-+H+═CO2↑+H2O可知,应该生成二氧化碳气体时消耗的盐酸体积等于没有生成二氧化碳时消耗的体积,故C错误;
D.向100mL 0.1mol/L的AlCl3和0.1mol/L的NH4Cl混合溶液中滴加1mol/L的NaOH溶液,铝离子的物质的量为0.01mol,完全反应变成氢氧化铝沉淀需要消耗氢氧化钠0.03nol,需要该氢氧化钠溶液的体积为30mL;再加入氢氧化钠溶液时,铵根离子优先与氢氧化钠反应,铵根离子的物质的量为0.01mol,需要消耗10mL的氢氧化钠溶液,当加入40mL氢氧化钠溶液后,氢氧化铝开始与氢氧化钠溶液反应,偏铝酸根离子浓度逐渐增大,0.01mol氢氧化铝完全反应消耗10mL氢氧化钠溶液,图中曲线变化与n(Al3+)和n(AlO2-)的变化情况相符,故D正确;
故选AD.
B.使用催化剂可以改变反应需要能量,但是根据盖斯定律可知,反应热与反应途径无关,所以使用催化剂不会改变反应的焓变,故B错误;
C.图象中没有生成二氧化碳时消耗了30mL的盐酸,生成二氧化碳只消耗了10mL体积的盐酸,根据反应的离子方程式CO32-+H+═HCO3-、HCO3-+H+═CO2↑+H2O可知,应该生成二氧化碳气体时消耗的盐酸体积等于没有生成二氧化碳时消耗的体积,故C错误;
D.向100mL 0.1mol/L的AlCl3和0.1mol/L的NH4Cl混合溶液中滴加1mol/L的NaOH溶液,铝离子的物质的量为0.01mol,完全反应变成氢氧化铝沉淀需要消耗氢氧化钠0.03nol,需要该氢氧化钠溶液的体积为30mL;再加入氢氧化钠溶液时,铵根离子优先与氢氧化钠反应,铵根离子的物质的量为0.01mol,需要消耗10mL的氢氧化钠溶液,当加入40mL氢氧化钠溶液后,氢氧化铝开始与氢氧化钠溶液反应,偏铝酸根离子浓度逐渐增大,0.01mol氢氧化铝完全反应消耗10mL氢氧化钠溶液,图中曲线变化与n(Al3+)和n(AlO2-)的变化情况相符,故D正确;
故选AD.
点评:本题考查了反应热与焓变的影响因素、溶解度与饱和溶液、离子方程式的有关计算,题目难度较大,试题涉及的知识点较多,充分考查了学生对所学知识的掌握情况,试题有利于培养学生的分析、理解能力.

练习册系列答案
相关题目
由乙炔(C2H2)、苯(C6H6)、苯乙烯(C8H8)和乙醛(CH3CHO)组成的混合物中碳的质量分数为60%,则氢的质量分数为( )
| A、5% | B、8.9% |
| C、17.8% | D、无法确定 |
将苯分子中的一个碳原子换成一个氮原子,得到一种类似苯环结构的稳定有机物,该有机物的一氯代物有几种( )
| A、1 | B、3 | C、4 | D、5 |
同位素在化学反应机理的研究中有着重要的作用.下列有关乙酸乙酯水解的化学方程式不正确的是( )
| A、CH3COOCH2CH3+HOD→CH3COOD+CH3CH2OH |
| B、CH3COOCH2CH3+HOD→CH3COOH+CH3CH2OD |
| C、CH3CO18OCH2CH3+H2O→CH3CO18OH+CH3CH2OH |
| D、CH3C18OOC H2CH3+H2O→CH3C18OOH+CH3CH2OH |
A、B、C、D、E是原子序数依次增大的五种短周期元素,A、E的原子核外最外层电子数之和为13,D原子的最外层电子数是C原子最外层电子数或电子层数的2倍,B与C同周期但不相邻.下列说法正确的是( )
| A、B与D形成的化合物为共价化合物 |
| B、E的单质能从水中置换出O2 |
| C、C的氧化物可溶于B、D、E的最高价氧化物对应的水化物溶液中 |
| D、五种元素的最高正化合价都等于其所在的族序数 |
气体甲(中学常见)通入溶液乙中,随着甲的通入,溶液乙的颜色逐渐褪去,加热褪色后的溶液不再恢复原来的颜色.下列说法正确的是( )
| A、气体甲一定不是SO2 |
| B、气体甲一定是Cl2 |
| C、气体甲一定不是发生了化合反应 |
| D、气体甲一定被溶液乙氧化 |
 的名称是
的名称是 分子式为
分子式为 某化学小组同学向一定量加入少量淀粉的NaHSO3溶液中加入稍过量的KIO3溶液,一段时间后,溶液突然变蓝色.
某化学小组同学向一定量加入少量淀粉的NaHSO3溶液中加入稍过量的KIO3溶液,一段时间后,溶液突然变蓝色.