题目内容
已知铅蓄电池的总反应PbO2+Pb+2H2SO4═2PbSO4+2H2O,图为铁铆钉铆在铜板上,有关叙述不正确的是( )
分析:A、放电是原电池,依据电池反应中的元素化合价变化计算消耗的硫酸;
B、阳极发生失电子的氧化反应,电极反应为PbSO4+2H2O-2e-=PbO2+4H++SO42-;
C、放电是原电池,溶液中H+向正极移动,硫酸根离子向负极移动;
D、铁铆钉发生吸氧腐蚀,铁作负极,生成Fe2+.
B、阳极发生失电子的氧化反应,电极反应为PbSO4+2H2O-2e-=PbO2+4H++SO42-;
C、放电是原电池,溶液中H+向正极移动,硫酸根离子向负极移动;
D、铁铆钉发生吸氧腐蚀,铁作负极,生成Fe2+.
解答:解:A、放电是原电池,依据电池反应Pb+PbO2+2H2SO4
2PbSO4+2H2O,转移电子2mol消耗2mol硫酸,故A错误;
B、阳极发生失电子的氧化反应,电极反应为PbSO4+2H2O-2e-=PbO2+4H++SO42-,故B正确;
C、放电是原电池,Pb是负极,硫酸根离子向负极(Pb)移动,溶液中H+向正极移动,所以正极附近溶液的pH增大,故C正确;
D、铁铆钉发生吸氧腐蚀,铁作负极,在铁附近生成Fe2+,Fe2+与K3[Fe(CN)6]溶液反应生成蓝色沉淀,故D正确;
故选A.
| 放电 |
| 充电 |
B、阳极发生失电子的氧化反应,电极反应为PbSO4+2H2O-2e-=PbO2+4H++SO42-,故B正确;
C、放电是原电池,Pb是负极,硫酸根离子向负极(Pb)移动,溶液中H+向正极移动,所以正极附近溶液的pH增大,故C正确;
D、铁铆钉发生吸氧腐蚀,铁作负极,在铁附近生成Fe2+,Fe2+与K3[Fe(CN)6]溶液反应生成蓝色沉淀,故D正确;
故选A.
点评:本题考查了原电池和电解池原理的应用,电极名称,电极反应的分析判断是解题关键,题目难度中等.

练习册系列答案
相关题目
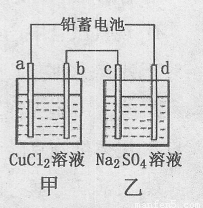
用铅蓄电池电解甲、乙电解池中的溶液。已知铅蓄电池的总反应为:Pb(s) + PbO2(s) + 2 H2SO4(aq)  2 PbSO4 (s) +2 H2O (l) 电解一段时间后向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是( )
2 PbSO4 (s) +2 H2O (l) 电解一段时间后向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是( )
| A.d极为阴极 |
| B.若利用甲池精炼铜,b极应为粗铜 |
| C.放电时铅蓄电池负极的电极反应式为: PbO2(s) + 4 H+(aq)+SO4 2-(aq)+4e- = PbSO4 (s) +2H2O (l) |
| D.若四个电极材料均为石墨,当析出6.4 g Cu时,两池中共产生气体3.36 L(标准状况下) |
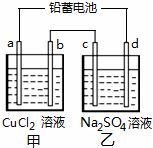 (2010?丰台区二模)用铅蓄电池电解甲、乙电解池中的溶液.已知铅蓄电池的总反应为:
(2010?丰台区二模)用铅蓄电池电解甲、乙电解池中的溶液.已知铅蓄电池的总反应为: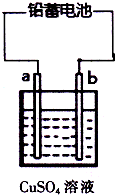 用铅蓄电池电解CuSO4溶液(如图).已知铅蓄电池的总反应为:
用铅蓄电池电解CuSO4溶液(如图).已知铅蓄电池的总反应为: 2PbSO4(s)+2H2O(1)
2PbSO4(s)+2H2O(1)