题目内容
【题目】2015年8月12日天津港特大爆炸事故,再一次引发了人们对环境问题的关注。据查危化仓库中存有大量的钠、钾、白磷(P4)、硝酸铵和氰化钠(NaCN)。爆炸事故中,因爆炸冲击导致氰化钠泄漏,可以通过喷洒双氧水或硫代硫酸钠溶液来处理,以减轻污染。
资料:氰化钠白色结晶颗粒、易潮解、有微弱的苦杏仁气味、剧毒、易溶于水、易水解生成氰化 氢、水溶液呈碱性。
(1)白磷有毒,能和氯酸溶液发生氧化还原反应:3P4 +10HC1O3 +18H2 O=10HC1+12H3 PO4,该反应的氧化产物是 ,若有1 mo1 P4参加反应转移电子为 mol。
(2)氰化钠(NaCN)是一种化工原料,用于基本化学合成、电镀、冶金和有机合成医药、农药及金属处理等方面。
①已知:25℃时,HCN的电离平衡常数Ka = 6.2×10-10,H2CO3在25℃时的电离平衡常数是Ka1=4.5×10-7 Ka2=4.7×10-11,则向NaCN溶液通入少量CO2反应方程式是: 。
②常温下,氰化钠能与过氧化氢溶液反应,生成碳酸氢钠和能使湿润的红色石蕊试纸变蓝色的气体,大大降低其毒性。该反应的化学方程式是: 。
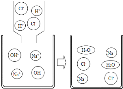
(3)实验室通过如图所示装置制备Na2SO3。

装置a中盛装Na2SO3固体的仪器名称是 ;装置b的作用是 。
(3)装置c中的产物有Na2S2O3和CO2气体等,实验结束后,装置d中的溶质有NaOH、Na2CO3,还可能有 。
(4)实验结束后,在e处最好连接盛 (选填“NaOH溶液”、“水”、“CC14”中任一种。
【答案】(1)H3PO4;20;(2)①CO2+NaCN+H2O=NaHCO3+HCN;②NaCN+H2O2+H2O=NaHCO3+NH3↑;(3)圆底烧瓶;安全瓶或防倒吸;(4)Na2SO3或Na2SO4;(5)NaOH溶液。
【解析】
试题分析:(1)氧化产物是还原剂失去电子转变成的物质,根据化合价的分析,P4中P的化合价由0→+5价,P4是还原剂,则H3PO4是氧化产物,3molP4参加反应共转移电子的物质的量为3×4×5mol=60mol,因此1molP4参加反应转移电子物质的量为60/3mol=20mol;(2)①根据电离平衡常数,电离出H+能力大小顺序是:H2CO3>HCN>HCO3-,因此此反应是:CO2+NaCN+H2O=NaHCO3+HCN;②使红色石蕊试纸变蓝的气体为NH3,CN-中C为+2价,N为-3价,因此化合价改变的是C和H2O2,因此根据化合价的升价法进行配平,NaCN+H2O2+H2O=NaHCO3+NH3↑;(3)盛放Na2SO3的仪器是圆底烧瓶,装置b的作用是安全瓶或防止倒吸的装置;(3)可能SO2过量,和NaOH反应生成Na2SO3,Na2SO3被氧化成Na2SO4;(5)e处处理过量的SO2,利用SO2属于酸性氧化物,最好用NaOH溶液。

 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案