题目内容
【题目】在一定温度下,10mL 0.40mol/L H2O2溶液发生催化分解,不同时刻测得生成O2的体积(已折算为标准状况)如下表.
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)( )
A.0~6 min的平均反应速率:v(H2O2)≈3.3×10﹣2 mol/(Lmin)
B.6~10 min的平均反应速率:v(H2O2)<3.3×10﹣2 mol/(Lmin)
C.反应到6 min时,H2O2分解了50%
D.反应到6 min时,c(H2O2)=0.30 mol/L
【答案】D
【解析】解:A.0~6min产生的氧气的物质的量n(O2)= ![]() =0.001mol,n(H202)=2n(O2)=0.002mol,v(H202)=
=0.001mol,n(H202)=2n(O2)=0.002mol,v(H202)= ![]() mol/(Lmin)≈3.3×10﹣2 mol/(Lmin),故A正确;
mol/(Lmin)≈3.3×10﹣2 mol/(Lmin),故A正确;
B.反应物浓度越大反应速率越大,随着反应进行,反应速率逐渐减小,前6min内反应速率为3.3×10﹣2 mol/(Lmin),则6~10 min的平均反应速率:v(H2O2)<3.3×10﹣2 mol/(Lmin),故B正确;
C.6min产生的氧气的物质的量n(O2)= ![]() =0.001mol,n(H202)=2n(O2)=0.002mol,其分解率=
=0.001mol,n(H202)=2n(O2)=0.002mol,其分解率= ![]() ×100%=50%,故C正确;
×100%=50%,故C正确;
D.6min时,c(H2O2)=(0.40﹣ ![]() )mol/L=0.20mol/L,故D错误;
)mol/L=0.20mol/L,故D错误;
故选D.
【考点精析】通过灵活运用化学平衡的计算,掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%即可以解答此题.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】饮用水中含有砷会导致砷中毒,水体中溶解的砷主要以As(Ⅲ)亚砷酸盐和As(Ⅴ)砷酸盐形式存在.
(1)砷与磷为同一主族元素,磷的原子结构示意图为 .
(2)根据元素周期律,下列说法正确的是 . a.酸性:H2SO4>H3PO4>H3AsO4
b.原子半径:S>P>As
c.非金属性:S>P>As
(3)关于地下水中砷的来源有多种假设,其中一种认为是富含砷的黄铁矿(FeS2)被氧化为Fe(OH)3 , 同时生成SO42﹣ , 导致砷脱离矿体进入地下水.FeS2被O2氧化的离子方程式为 .
(4)去除水体中的砷,可先将As(Ⅲ)转化为As(Ⅴ),选用NaClO可实现该转化.研究NaClO投加量对As(Ⅲ)氧化率的影响得到如下结果: 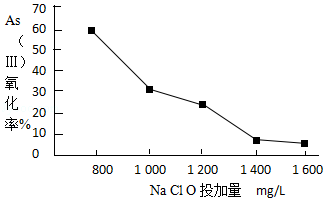
已知:投料前水样pH=5.81,0.1mol/LNaClO溶液pH=10.5,溶液中起氧化作用的物质是次氯酸.产生此结果的原因是 .
(5)强阴离子交换柱可以吸附以阴离子形态存在的As(Ⅴ)达到去除As的目的. 已知:一定条件下,As(Ⅴ)的存在形式如表所示:
pH | <2 | 2~7 | 7~11 | 11~14 |
存在形式 | H3AsO4 | H2AsO3﹣ | HAsO42﹣ | HAsO42﹣、AsO43﹣ |
pH=6时,NaClO氧化亚砷酸(H3AsO3)的离子方程式是 .