题目内容
根据已学知识,请你回答下列问题:
(1)写出原子序数最小的第Ⅷ族元素原子的原子结构示意图为: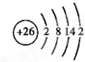
 .
.
(2)写出3p轨道上有2个未成对电子的元素的符号:
(3)该元素被科学家称之为人体微量元素中的“防癌之王”,其原子的外围电子排布是4s24p4,该元素的名称是
(4)第三主族的元素由于最外能层的p能级中有空轨道,故称为缺电子元素.硼酸的结构式可表示为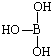 ,但硼酸溶于水后,1个硼酸分子与水作用,只能产生1个H+,请写出硼酸溶于水后溶液显酸性的离子方程式:
,但硼酸溶于水后,1个硼酸分子与水作用,只能产生1个H+,请写出硼酸溶于水后溶液显酸性的离子方程式:
(5)写出二氧化硫和水合氢离子中硫原子,氧原子分别采用
(6)已知N-N,N=N,N≡N键能之比为1.00:2.17:4.90,而C-C,C=C,C≡C键能之比为1.00:1.77:2.34.用数据分析氮分子不容易发生加成反应而乙烯和乙炔容易发生加成反应的原因
(7)用氢键表示法表示邻羟基苯甲醛分子内氢键
 .
.
(1)写出原子序数最小的第Ⅷ族元素原子的原子结构示意图为:


(2)写出3p轨道上有2个未成对电子的元素的符号:
Si或S
Si或S
.(3)该元素被科学家称之为人体微量元素中的“防癌之王”,其原子的外围电子排布是4s24p4,该元素的名称是
硒
硒
.(4)第三主族的元素由于最外能层的p能级中有空轨道,故称为缺电子元素.硼酸的结构式可表示为
 ,但硼酸溶于水后,1个硼酸分子与水作用,只能产生1个H+,请写出硼酸溶于水后溶液显酸性的离子方程式:
,但硼酸溶于水后,1个硼酸分子与水作用,只能产生1个H+,请写出硼酸溶于水后溶液显酸性的离子方程式:B(OH)3+H2O?B(OH)4-+H+
B(OH)3+H2O?B(OH)4-+H+
.(5)写出二氧化硫和水合氢离子中硫原子,氧原子分别采用
sp2
sp2
和sp3
sp3
杂化形式,其空间构型分别为V形
V形
和三角锥型
三角锥型
.(6)已知N-N,N=N,N≡N键能之比为1.00:2.17:4.90,而C-C,C=C,C≡C键能之比为1.00:1.77:2.34.用数据分析氮分子不容易发生加成反应而乙烯和乙炔容易发生加成反应的原因
N≡N键能大于N-N键能的三倍,N=N的键能大于N-N的二倍,而C≡C键能小于C-C键能的三倍,C=C键能小于C-C键能的二倍.说明乙烯和乙炔中的π键不牢固,容易被试剂进攻,故易发生加成反应.而氮分子中N≡N非常牢固,不易发生加成反应
N≡N键能大于N-N键能的三倍,N=N的键能大于N-N的二倍,而C≡C键能小于C-C键能的三倍,C=C键能小于C-C键能的二倍.说明乙烯和乙炔中的π键不牢固,容易被试剂进攻,故易发生加成反应.而氮分子中N≡N非常牢固,不易发生加成反应
.(7)用氢键表示法表示邻羟基苯甲醛分子内氢键


分析:(1)原子序数最小的第Ⅷ族元素为Fe,核外电子数为29,根据核外电子排布规律书画出Fe原子结构示意图;
(2)3p轨道上有2个未成对电子的元素,其核外电子排布式为1s22s22p62s23p2或1s22s22p62s23p4;
(3)该元素被科学家称之为人体微量元素中的“防癌之王”,其原子的外围电子排布是4s24p4,处于都是周期ⅥA族,为Se元素;
(4)硼酸分子中B原子含有空轨道,与水电离出的氢氧根离子形成配位键形成B(OH)4-,同时产生1个H+;
(5)计算氧原子的价层电子数与氧原子的孤对电子对数,判断杂化方式与水合氢离子的空间构型,计二氧化硫中硫原子的价层电子数与氧原子的孤对电子对数,确定其空间结构;
(6)由键能比例关系可知,N≡N键能大于N-N键能的三倍,N=N的键能大于N-N的二倍,而C≡C键能小于C-C键能的三倍,C=C键能小于C-C键能的二倍,键能越小化学键越不稳定,反应越容易进行;
(7)邻羟基苯甲醛分子内羟基H原子与醛基中氧原子之间形成氢键.
(2)3p轨道上有2个未成对电子的元素,其核外电子排布式为1s22s22p62s23p2或1s22s22p62s23p4;
(3)该元素被科学家称之为人体微量元素中的“防癌之王”,其原子的外围电子排布是4s24p4,处于都是周期ⅥA族,为Se元素;
(4)硼酸分子中B原子含有空轨道,与水电离出的氢氧根离子形成配位键形成B(OH)4-,同时产生1个H+;
(5)计算氧原子的价层电子数与氧原子的孤对电子对数,判断杂化方式与水合氢离子的空间构型,计二氧化硫中硫原子的价层电子数与氧原子的孤对电子对数,确定其空间结构;
(6)由键能比例关系可知,N≡N键能大于N-N键能的三倍,N=N的键能大于N-N的二倍,而C≡C键能小于C-C键能的三倍,C=C键能小于C-C键能的二倍,键能越小化学键越不稳定,反应越容易进行;
(7)邻羟基苯甲醛分子内羟基H原子与醛基中氧原子之间形成氢键.
解答:解:(1)原子序数最小的第Ⅷ族元素为Fe,核外电子数为29,有4个电子层,根据核外电子排布规律,由里到外各层电子数为2、8、14、2,Fe原子结构示意图为 ,故答案为:
,故答案为: ;
;
(2)3p轨道上有2个未成对电子的元素,其核外电子排布式为1s22s22p62s23p2或1s22s22p62s23p4,为Si元素或S元素,故答案为:Si或S;
(3)该元素被科学家称之为人体微量元素中的“防癌之王”,其原子的外围电子排布是4s24p4,处于都是周期ⅥA族,为Se元素,故答案为:硒;
(4)硼酸分子中B原子含有空轨道,与水电离出的氢氧根离子形成配位键形成B(OH)4-,同时产生1个H+,硼酸溶于水后溶液显酸性的离子方程式为:B(OH)3+H2O?B(OH)4-+H+,故答案为:B(OH)3+H2O?B(OH)4-+H+;
(5)二氧化硫分子是O原子价层电子对2+
(6-2×2)=3,氧原子孤对电子对数为1,氧原子采取sp2杂化,二氧化硫分子中硫原子价层电子对2+
(6-2×2)=3,氧原子孤对电子对数为1,空间构型为V形;
水合氢离子中氧原子的价层电子对3+
(6-1-3×1)=4,氧原子孤对电子对数为1,氧原子采取sp3杂化,水合氢离子空间构型为三角锥型,
故答案为:sp2;sp3;V形;三角锥型;
(6)N≡N键能大于N-N键能的三倍,N=N的键能大于N-N的二倍,而C≡C键能小于C-C键能的三倍,C=C键能小于C-C键能的二倍.说明乙烯和乙炔中的π键不牢固,容易被试剂进攻,故易发生加成反应.而氮分子中N≡N非常牢固,不易发生加成反应,
故答案为:N≡N键能大于N-N键能的三倍,N=N的键能大于N-N的二倍,而C≡C键能小于C-C键能的三倍,C=C键能小于C-C键能的二倍.说明乙烯和乙炔中的π键不牢固,容易被试剂进攻,故易发生加成反应.而氮分子中N≡N非常牢固,不易发生加成反应;
(7)邻羟基苯甲醛分子内羟基H原子与醛基中氧原子之间形成氢键,分子中氢键如图所示: ,故答案为:
,故答案为: .
.
 ,故答案为:
,故答案为: ;
;(2)3p轨道上有2个未成对电子的元素,其核外电子排布式为1s22s22p62s23p2或1s22s22p62s23p4,为Si元素或S元素,故答案为:Si或S;
(3)该元素被科学家称之为人体微量元素中的“防癌之王”,其原子的外围电子排布是4s24p4,处于都是周期ⅥA族,为Se元素,故答案为:硒;
(4)硼酸分子中B原子含有空轨道,与水电离出的氢氧根离子形成配位键形成B(OH)4-,同时产生1个H+,硼酸溶于水后溶液显酸性的离子方程式为:B(OH)3+H2O?B(OH)4-+H+,故答案为:B(OH)3+H2O?B(OH)4-+H+;
(5)二氧化硫分子是O原子价层电子对2+
| 1 |
| 2 |
| 1 |
| 2 |
水合氢离子中氧原子的价层电子对3+
| 1 |
| 2 |
故答案为:sp2;sp3;V形;三角锥型;
(6)N≡N键能大于N-N键能的三倍,N=N的键能大于N-N的二倍,而C≡C键能小于C-C键能的三倍,C=C键能小于C-C键能的二倍.说明乙烯和乙炔中的π键不牢固,容易被试剂进攻,故易发生加成反应.而氮分子中N≡N非常牢固,不易发生加成反应,
故答案为:N≡N键能大于N-N键能的三倍,N=N的键能大于N-N的二倍,而C≡C键能小于C-C键能的三倍,C=C键能小于C-C键能的二倍.说明乙烯和乙炔中的π键不牢固,容易被试剂进攻,故易发生加成反应.而氮分子中N≡N非常牢固,不易发生加成反应;
(7)邻羟基苯甲醛分子内羟基H原子与醛基中氧原子之间形成氢键,分子中氢键如图所示:
 ,故答案为:
,故答案为: .
.点评:本题考查结合性质位置关系、核外电子排布、杂化理论与分子构型、键能与分子性质关系、氢键等,题目综合性较大,侧重对基础知识的巩固,难度中等.

练习册系列答案
相关题目