题目内容
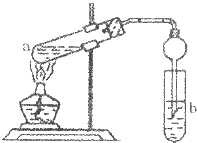 “酒是陈年的香”是因为酒在储存中会生成有香味的乙酸乙酯.在实验室我们可以用如图所示装置来制取乙酸乙酯:在试管a中先加入3mL的无水乙醇和2mL浓硫酸混合液,冷却后再加入2mL冰醋酸,混合均匀后将试管固定在铁架台上,在试管b中加入7mL饱和碳酸钠溶液.装置连接好后,用酒精灯对试管a加热,当试管b中收集到较多的乙酸乙酯时停止实验.请回答下列问题:
“酒是陈年的香”是因为酒在储存中会生成有香味的乙酸乙酯.在实验室我们可以用如图所示装置来制取乙酸乙酯:在试管a中先加入3mL的无水乙醇和2mL浓硫酸混合液,冷却后再加入2mL冰醋酸,混合均匀后将试管固定在铁架台上,在试管b中加入7mL饱和碳酸钠溶液.装置连接好后,用酒精灯对试管a加热,当试管b中收集到较多的乙酸乙酯时停止实验.请回答下列问题:(1)在试管a中混合乙醇和浓硫酸的操作是
(2)在实验中球形干燥管除导气、冷凝作用外,另一个重要作用是
(3)b试管中选择饱和Na2CO3溶液而不选用饱和氢氧化钠溶液的原因是
(4)生成乙酸乙酯的反应比较缓慢,为了提高该反应的速率,本实验中采用的措施是
(5)上述b试管得到的乙酸乙酯含有很多杂质(粗乙酸乙酯),必须进行提纯才能得到纯乙酸乙酯,其流程如下:
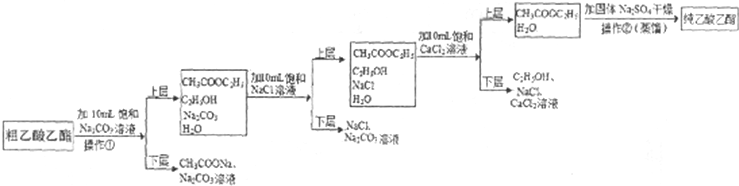
①操作①的名称
②加10mLCaCl2溶液洗涤乙酸乙酯时,要先加饱和NaCl溶液洗涤的原因是
分析:(1)浓硫酸密度大,应将浓硫酸加入到乙醇中,以防酸液飞溅,乙酸易挥发,冷却后再加入乙酸;
(2)球形干燥管还起到防止倒吸的作用;
(3)乙酸乙酯能够与氢氧化钠溶液发生反应生成乙醇和醋酸钠,无法获得乙酸乙酯;
(4)根据该反应条件及温度、催化剂对化学反应速率的影响进行解答;
(5)①操作①分离互不相溶的混合液体,操作方法为分液;操作②需要进行蒸馏,使用的仪器为蒸馏烧瓶;
②根据直接使用氯化钙溶液,可能导致生成碳酸钙沉淀,影响分液效果进行解答.
(2)球形干燥管还起到防止倒吸的作用;
(3)乙酸乙酯能够与氢氧化钠溶液发生反应生成乙醇和醋酸钠,无法获得乙酸乙酯;
(4)根据该反应条件及温度、催化剂对化学反应速率的影响进行解答;
(5)①操作①分离互不相溶的混合液体,操作方法为分液;操作②需要进行蒸馏,使用的仪器为蒸馏烧瓶;
②根据直接使用氯化钙溶液,可能导致生成碳酸钙沉淀,影响分液效果进行解答.
解答:解:(1)为防止酸液飞溅,应将密度大的液体加入到密度小的液体中,乙酸易挥发,冷却后再加入乙酸,
故答案为:先向试管a中加入乙醇,然后缓慢的向试管注入浓硫酸,边加边摇动试管;
(2)挥发出来的乙酸和乙醇易溶于饱和碳酸钠溶液,容易发生倒吸现象,而使用球形干燥管可以防止倒吸,
故答案为:防止倒吸;
(3)乙酸乙酯能够与氢氧化钠溶液反应,反应的化学方程式为:CH3COOC2H5+NaOH
CH3COONa+C2H5OH,所以使用氢氧化钠溶液无法获得乙酸乙酯,
故答案为:CH3COOC2H5+NaOH
CH3COONa+C2H5OH;
(4)为了加快反应速率,该反应采取的措施为:对试管a加热、加入浓硫酸作催化剂,
故答案为:对试管a加热;加入浓硫酸作催化剂;
(5)①操作①将饱和碳酸钠溶液与乙酸乙酯分离,二者不相容,可以通过分液操作分离;操作②为蒸馏,使用的仪器为蒸馏烧瓶,
故答案为:分液;蒸馏烧瓶;
②由于当酯层用饱和碳酸钠溶液洗涤过后,若紧接着就用饱和CaCl2溶液直接洗涤,有可能产生絮状的碳酸钙沉淀,使进一步分液变得困难,所以加10mLCaCl2溶液洗涤乙酸乙酯时,要先加饱和NaCl溶液洗涤,
故答案为:当酯层用饱和碳酸钠溶液洗涤过后,若紧接着就用饱和CaCl2溶液直接洗涤,有可能产生絮状的碳酸钙沉淀,使进一步分液变得困难.
故答案为:先向试管a中加入乙醇,然后缓慢的向试管注入浓硫酸,边加边摇动试管;
(2)挥发出来的乙酸和乙醇易溶于饱和碳酸钠溶液,容易发生倒吸现象,而使用球形干燥管可以防止倒吸,
故答案为:防止倒吸;
(3)乙酸乙酯能够与氢氧化钠溶液反应,反应的化学方程式为:CH3COOC2H5+NaOH
| △ |
故答案为:CH3COOC2H5+NaOH
| △ |
(4)为了加快反应速率,该反应采取的措施为:对试管a加热、加入浓硫酸作催化剂,
故答案为:对试管a加热;加入浓硫酸作催化剂;
(5)①操作①将饱和碳酸钠溶液与乙酸乙酯分离,二者不相容,可以通过分液操作分离;操作②为蒸馏,使用的仪器为蒸馏烧瓶,
故答案为:分液;蒸馏烧瓶;
②由于当酯层用饱和碳酸钠溶液洗涤过后,若紧接着就用饱和CaCl2溶液直接洗涤,有可能产生絮状的碳酸钙沉淀,使进一步分液变得困难,所以加10mLCaCl2溶液洗涤乙酸乙酯时,要先加饱和NaCl溶液洗涤,
故答案为:当酯层用饱和碳酸钠溶液洗涤过后,若紧接着就用饱和CaCl2溶液直接洗涤,有可能产生絮状的碳酸钙沉淀,使进一步分液变得困难.
点评:本题考查了乙酸乙酯的制取、物质的分离与提纯,题目难度不大,注意掌握乙酸乙酯的反应原理、装置选择及选用的试剂的作用,明确物质的分离与提纯常用的方法及正确操作方法.

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目