题目内容
在标准状况下氢气和一氧化碳的混合气体7 L,质量为2.25 g,求H2和CO的质量分数和体积分数。解析:一种思路可设H2、CO各自的质量,然后分别根据质量求出体积,使它们之和为7 L,联立方程求解。另一思路是由混合气体的体积和质量求出混合气体在22.4 L时的质量,得出平均摩尔质量后找出体积关系或质量关系解题。
解法一:设CO质量为x,H2质量为y。
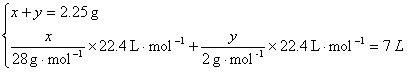
![]()
CO体积:![]() ×22.4 L·mol-1=1.4 L
×22.4 L·mol-1=1.4 L
H2体积:![]() ×22.4 L·mol-1=5.6 L
×22.4 L·mol-1=5.6 L
所以w(H2)=![]() ×100%=22.2%
×100%=22.2%
Ф(H2)=![]() ×100%=80%
×100%=80%
ω(CO)=![]() ×100%=77.8%
×100%=77.8%
Ф(CO)=![]() ×100%=20%
×100%=20%
解法二:设CO、H2的物质的量分别为x、y,则:

求得![]()
其他同解法一。
解法三:设H2的体积为x,则CO的体积为(7 L-x)。
![]() ×2 g·mol-1+
×2 g·mol-1+![]() ×28 g·mol-1=2.25 g
×28 g·mol-1=2.25 g
x=5.6 L,CO为1.4 L。
H2的质量:
![]() ×2 g·mol-1=0.5 g
×2 g·mol-1=0.5 g
CO的质量:2.25 g-0.5 g=1.75 g
其他同解法一。
解法四:设混合气体平均摩尔质量为![]() ,体积分数H2为x%,CO为(1-x%)。
,体积分数H2为x%,CO为(1-x%)。
①求混合气体的摩尔质量:
![]() =
=![]()
![]() =7.2g·mol-1
=7.2g·mol-1
②求体积分数:x%×2 g·mol-1+(1-x%)×28 g·mol-1=7.2 g·mol-1
φ(H2)%=80%,φ(CO)20%。
③求质量分数:由②知
V(H2)∶V(CO)=80∶20=4∶1=n(H2)∶n(CO)
H2与CO的质量比为
(4×2)∶(1×28)=2∶7
w(H2)=![]() ×100%=22.2%
×100%=22.2%
w(CO)=![]() ×100%=77.8%
×100%=77.8%
解法五:①求混合气平均摩尔质量,解法同前得![]() =7.2 g·mol-1
=7.2 g·mol-1
②用十字交叉法求H2和CO的体积比(即物质的量比)
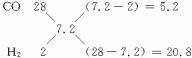
故V(CO)∶V(H2)=5.2∶20.8=1∶4,其他解法同前。

练习册系列答案
相关题目
 在标准状况下,有一刚性密闭容器,被一可以自由滑动的活塞分成两个密闭的反应器.左侧充入等物质的量的氢气和氧气,右侧充入一氧化碳和氧气的混合气体.同时引燃左右两侧的混合气,反应后恢复到标准状况.反应前后活塞位置如下图所示.则右侧混合气体中一氧化碳和氧气的物质的量之比是
在标准状况下,有一刚性密闭容器,被一可以自由滑动的活塞分成两个密闭的反应器.左侧充入等物质的量的氢气和氧气,右侧充入一氧化碳和氧气的混合气体.同时引燃左右两侧的混合气,反应后恢复到标准状况.反应前后活塞位置如下图所示.则右侧混合气体中一氧化碳和氧气的物质的量之比是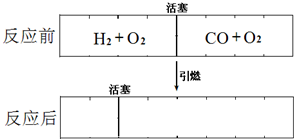 在标准状况下,有一刚性密闭容器,被一可以自由滑动的活塞分成两个密闭的反应器.左侧充入等物质的量的氢气和氧气,右侧充入一氧化碳和氧气的混合气体.同时引燃左右两侧的混合气,反应后恢复到标准状况.反应前后活塞位置如下图所示.则右侧混合气体中一氧化碳和氧气的物质的量之比是________或________.(液态水的体积忽略不计)
在标准状况下,有一刚性密闭容器,被一可以自由滑动的活塞分成两个密闭的反应器.左侧充入等物质的量的氢气和氧气,右侧充入一氧化碳和氧气的混合气体.同时引燃左右两侧的混合气,反应后恢复到标准状况.反应前后活塞位置如下图所示.则右侧混合气体中一氧化碳和氧气的物质的量之比是________或________.(液态水的体积忽略不计)
