题目内容
(1)常温下pH=5 HCl溶液和pH=5的AlCl3溶液中由水电离产生的c (H+) 之比等于 。
(2)写出泡沫灭火器灭火时发生反应的离子方程式 。
(3)常温下将0.01molCH3COONa和0.02mol盐酸溶于水,配成0.5L混合溶液。溶液中共有 种微粒,各离子浓度从大到小的顺序为 。
(4)常温下,向100 mL 0.01 mol·L-1HA溶液逐滴加入0.02 mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(忽略溶液混合时的体积变化)。
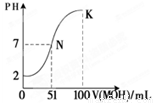
回答下列问题:
①由图中信息可知HA为_______酸(填“强”或“弱”) ② K点对应的溶液中c(M+)+c(MOH)= mol·L-1。
(1) 10-4:1或1:104; (2) Al3++3HCO3-=Al(OH)3↓+3CO2↑
(3) 7;C(Cl-)>C(H+)>C(Na+)>C(CH3COO-)>C(OH-);(4) ①强 ②0.01
【解析】
试题分析:(1)常温下pH=5 HCl的溶液,C(H+)=10-5mol/L,C(OH-)= C(H+)(水)=10-9mol/L, pH=5的AlCl3溶液C(H+)(水)=10-5mol/L 。所以二者由水电离产生的c (H+) 之比等于10-9mol/L:10-5mol/L=10-4:1=1:104. (2)泡沫灭火器灭火时发生反应的离子方程式为:Al3++3HCO3-=Al(OH)3↓+3CO2↑(3)常温下将0.01molCH3COONa和0.02mol盐酸溶于水,配成0.5L混合溶液。溶液中共有H2O 、CH3COOH、H+、Cl-、CH3COO- 、Na+、 OH-七种微粒。HCl+CH3COONa= CH3COOH+NaCl.n(Na+)=0.01mol,n(Cl-)=0.02mol,由于CH3COOH的电离作用大于CH3COO-的水解作用,所以n(CH3COOH)>0.01mol, n(CH3COO-) < 0.01mol.n(H+)>n(OH-).各离子浓度从大到小的顺序为C(Cl-)>C(H+)> C(Na+)>C(CH3COO-)> C(OH-).(4) 100 mL 0.01 mol·L-1HA与51ml的0.02 mol·L-1MOH溶液混合溶液恰好为中性,说明HA为强酸,MOH为弱碱。K点对应的溶液中c(M+)+c(MOH)=( 0.02 mol/L×0.1L)÷0.2L=0.01mol/L.
考点:考查酸溶液、盐溶液中水的电离、溶液中离子浓度的比较、泡沫灭火器的原理等知识。

 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案