题目内容
(13分)某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化:
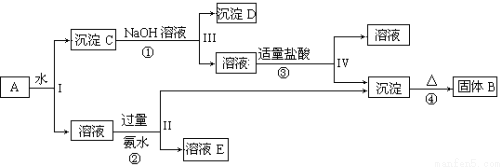
据此回答下列问题:
(1)I、II、III、IV四步中对于溶液和沉淀的分离采取的方法是 。
(2)根据上述框图反应关系,写出下列B、 D所含物质的化学式
固体B ;沉淀D 。
(3)写出①、②反应的离子方程式:
① ;② ;
(4)以Fe2O3为原料,可制备FeCl2溶液,请写出有关的化学反应方程式,试剂任选。
(1)过滤;(2)Al2O3;;Fe2O3;
(3)①Al2O3+2OH- =2AlO2-+H2O (2分)
②Al3++3NH3·H2O=Al(OH) 3↓+3NH4+ (2分)
(4)Fe2O3 + 6HCl = 2 FeCl3 + 3 H2O ;(2分) (其余合理答案也可给分)
2FeCl3 + Fe = 3FeCl2 (2分)
【解析】
试题分析:根据题意知,混合物A含有KAl(SO4)2、Al2O3和Fe2O3,加水后经过滤可得KAl(SO4)2溶液和Al2O3、Fe2O3沉淀混合物C,向混合物C中加入NaOH溶液,NaOH和Al2O3反应生成NaAlO2,过滤后得到NaAlO2溶液,沉淀D为Fe2O3, NaAlO2溶液中加入适量盐酸,反应生成Al(OH)3和NaCl,Al(OH)3加热分解生成B为Al2O3,溶液KAl(SO4)2中通入过量氨气生成氢氧化铝沉淀和溶液E,溶液E为K2SO4和(NH4)2SO4混合物;(1)根据题给流程图知,I、II、III、IV四步为溶液和沉淀的分离,采取的方法是过滤;(2)由以上分析可知B为Al2O3,D为Fe2O3;(3)反应①为Al2O3和氢氧化钠的反应,方程式为Al2O3+2NaOH=2NaAlO2+H2O,反应②为Al3+和氨水的反应,反应的离子方程式为Al3++3NH3、H2O=Al(OH)3↓+3 NH4+;(4)以Fe2O3为原料,可制备FeCl2溶液,可将氧化铁先与盐酸反应,生成氯化铁和水,然后再加入过量铁粉充分反应后过滤即得氯化亚铁溶液,反应方程式为Fe2O3 + 6HCl = 2 FeCl3 + 3 H2O ;2FeCl3 + Fe = 3FeCl2。
考点:本题以化学工艺流程为载体考查物质的分离提纯及铁、铝及其化合物的性质。