题目内容
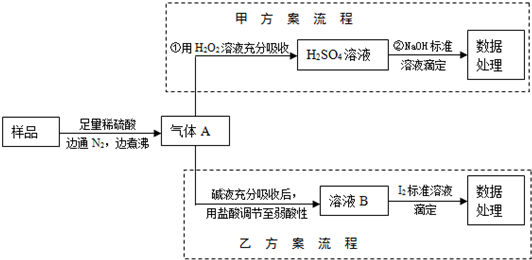
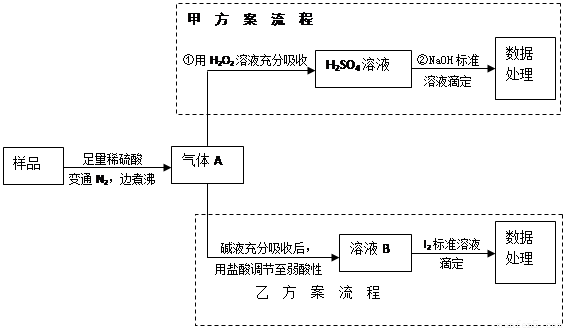
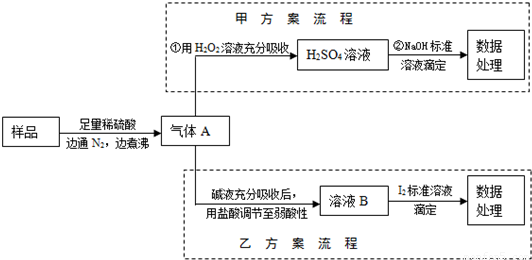
亚硫酸盐是一种常见的食品添加剂.为检验某食品中亚硫酸盐含量(通常以1kg样品中含SO2的质量计),某研究小组同学设计了如图实验流程(所加试剂均为足量).
请回答:(1)亚硫酸盐作为食品添加剂的作用是
a.防腐保鲜 b.增强营养
(2)反应①中通入N2的目的是
a.冷却产生的气体b.与生成的气体反应c.将生成的气体全部赶出
(3)反应①~③中属于氧化还原反应的是
(4)若取样品X g,反应③消耗0.01mol/L NaOH溶液100mL,则1kg样品中含SO2的质量是
分析:(1)亚硫酸根离子具有强的还原性,易被氧气氧化为硫酸盐;
(2)亚硫酸根离子可以喝强酸之间反应得到二氧化硫,氮气和二氧化硫之间不会反应;
(3)有元素化合价变化的反应是氧化还原反应;
(4)根据化学反应结合原子守恒知识来回答判断.
(2)亚硫酸根离子可以喝强酸之间反应得到二氧化硫,氮气和二氧化硫之间不会反应;
(3)有元素化合价变化的反应是氧化还原反应;
(4)根据化学反应结合原子守恒知识来回答判断.
解答:解:亚硫酸盐样品中加入稀硫酸之后,会发生反应得到二氧化硫气体,二氧化硫会被氮气完全排出,得到气体A是二氧化硫,二氧化硫具有还原性,能被双氧水氧化为硫酸,硫酸可以和氢氧化钠之间发生中和反应生成硫酸钠.
(1)亚硫酸根离子具有强的还原性,易被氧气氧化为稳定的硫酸盐,所以亚硫酸盐可以防腐保鲜,作为食品添加剂,故答案为:a;
(2)亚硫酸盐样品中加入稀硫酸之后,会发生反应得到二氧化硫气体,氮气和二氧化硫之间不会反应,反应①中通入N2可以将生成的气体二氧化硫全部赶出,
故答案为:c;
(3)反应①是亚硫酸根离子和氢离子之间的反应,不是氧化还原反应,②是二氧化硫和双氧水之间的反应,属于氧化还原反应,是硫酸和氢氧化钠之间的中和反应,不属于氧化还原反应,故答案为:②;
(4)③消耗0.01mol/L NaOH溶液100mL,所以硫酸的物质的量是0.0005mol,所以硫原子的物质的量是0.0005mol,根据硫原子守恒,Xg样品中含有的二氧化硫的质量是
×64g/mol=0.032g,则1kg样品中含SO2的质量是
g,故答案为:
.
(1)亚硫酸根离子具有强的还原性,易被氧气氧化为稳定的硫酸盐,所以亚硫酸盐可以防腐保鲜,作为食品添加剂,故答案为:a;
(2)亚硫酸盐样品中加入稀硫酸之后,会发生反应得到二氧化硫气体,氮气和二氧化硫之间不会反应,反应①中通入N2可以将生成的气体二氧化硫全部赶出,
故答案为:c;
(3)反应①是亚硫酸根离子和氢离子之间的反应,不是氧化还原反应,②是二氧化硫和双氧水之间的反应,属于氧化还原反应,是硫酸和氢氧化钠之间的中和反应,不属于氧化还原反应,故答案为:②;
(4)③消耗0.01mol/L NaOH溶液100mL,所以硫酸的物质的量是0.0005mol,所以硫原子的物质的量是0.0005mol,根据硫原子守恒,Xg样品中含有的二氧化硫的质量是
×64g/mol=0.032g,则1kg样品中含SO2的质量是
| 32 |
| X |
| 32 |
| X |
点评:本题目以工艺流程题的方式考查学生元素以及化合物的性质知识,注意原子守恒思想在解题中的应用,难度不大.

练习册系列答案
 互动英语系列答案
互动英语系列答案
相关题目