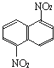
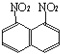
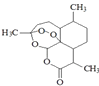
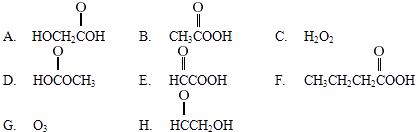题目内容
【题目】阅读相关信息,结合所学知识,回答下列问题:
(1)铝和锌都是两性金属元素。其氢氧化物都是白色沉淀,既能溶于强酸,又能溶于强碱(生成AlO2-或ZnO22-)。但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成[Zn(NH3)4]2+。
①写出锌和氢氧化钠溶液反应的化学方程式_________________________________。
②用氨水除去Al(OH)3中的Zn(OH)2的离子方程式为__________________________。
③写出向AlCl3溶液中滴入过量氨水的离子方程式___________________________;
向ZnCl2溶液中逐滴滴入氨水直至过量的现象是___________________________。
④下列各组中的两种溶液,只用胶头滴管和试管即可鉴别的是________________。
A.硫酸铝和氢氧化钠 B.硫酸铝和氨水
C.硫酸锌和氢氧化钠 D.硫酸锌和氨水
(2)Cu2O是一种红色难溶于水的固体,在空气中灼烧Cu2O会生成CuO;Cu2O溶于稀硫酸可生成Cu和Cu2+;Cu2O和Cu都能溶于稀硝酸。
研究性学习小组为检测Cu样品中是否含有Cu2O设计以下实验方案:
方案Ⅰ:取该红色样品溶于足量的稀硝酸中,观察是否有残渣剩余
方案Ⅱ:取该红色样品溶于足量的稀硫酸中,观察溶液颜色变化
方案Ⅲ:称量a g红色样品,在空气中充分灼烧至恒重,得到bg黑色固体。
①比较方案Ⅰ和方案Ⅱ,你认为合理的是方案_________(填“Ⅰ”或“Ⅱ”),合理方案的反应原理为________________________________________(用离子方程式表示)。
②方案Ⅲ中,如果 < b < (用含a的代数式表示)____________,可确认红色粉末含有Cu2O。
【答案】 Zn+2NaOH = Na2ZnO2+ H2↑ Zn(OH)2 + 4NH3·H2O = [Zn(NH3)4]2++ 2OH- + 4H2O Al3+ +3NH3·H2O = 3NH4++ Al(OH)3↓ 先产生白色沉淀,后白色沉淀消失 A、C、D Ⅱ Cu2O+2H+= Cu+Cu2++H2O 10a/9,5a/4
【解析】(1)根据信息铝和锌都是两性金属元素。其氢氧化物都是白色沉淀,既能溶于强酸,又能溶于强碱(生成AlO2-或ZnO22-)。但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成[Zn(NH3)4]2+。①写出锌和氢氧化钠溶液反应的化学方程式:. Zn+2NaOH = Na2ZnO2+ H2↑ 。
②因为氢氧化铝不溶于氨水,氢氧化锌能溶于氨水,生成[Zn(NH3)4]2+,所以用氨水除去Al(OH)3中的Zn(OH)2的离子方程式为:Zn(OH)2 + 4NH3·H2O = [Zn(NH3)4]2++ 2OH- + 4H2O。
③因为氢氧化铝不溶于氨水,写出向AlCl3溶液中滴入过量氨水的离子方程式Al3+ +3NH3·H2O = 3NH4++ Al(OH)3↓;向ZnCl2溶液中逐滴滴入氨水首先生Zn(OH)2白色沉淀,继续滴加又会发生Zn(OH)2 + 4NH3·H2O = [Zn(NH3)4]2++ 2OH- + 4H2O反应,沉淀又溶解了。所以此反应过程的现象是:先产生白色沉淀,后白色沉淀消失。
④向硫酸铝溶液中滴加氢氧化钠溶液先产生白色沉淀,继续滴加沉淀溶解;向氢氧化钠溶液中滴加硫酸铝溶液开始没有沉淀产生,继续滴加产生白色沉淀。所以A可以用胶头滴管和试管即可鉴别,故A正确;B.硫酸铝和氨水反应只生成白色沉淀,氢氧化铝不能溶于过量的氨水,用胶头滴管和试管不可鉴别,故B错;C.硫酸锌溶液滴加和氢氧化钠溶液先产生白色沉淀,继续滴加白色沉淀溶解;氢氧化钠溶液滴加硫酸锌溶液先没有沉淀产生,继续滴加产生白色沉淀。所以C可以用胶头滴管和试管即可鉴别; 故C正确。D.硫酸锌滴入氨水溶液,先无白色沉淀生成,继续滴加,产生白色沉淀,沉淀溶解;硫酸锌滴入氨水溶液,先产生白色沉淀,继续滴加,白色沉淀溶解,故D正确。本题正确答案:A C D。
(2)①方案Ⅰ:取该红色样品溶于足量的稀硝酸中,因为Cu2O和Cu都能溶于稀硝酸,所以不会有残渣剩余。所以方案Ⅰ不合理。方案Ⅱ:取该红色样品溶于足量的稀硫酸中,因为Cu2O溶于稀硫酸可生成Cu和Cu2,如果观察溶液颜色变蓝,说明有Cu2O,如果不变蓝,说明没有。故方案Ⅱ比较合理。合理方案的反应原理为Cu2O+2H+= Cu+Cu2++H2O
② 假设都是铜 假设都是Cu2O
根据反应: 2Cu + O2 = 2CuO 2Cu2O + O2= 4CuO
a/ 128 b/160 a/288 b/320
b=![]() b=
b=![]()
所以b=![]()
![]() 可确认红色粉末含有Cu2O。
可确认红色粉末含有Cu2O。

【题目】下列实验现象描述错误的是
编号 | 实验 | 现象 |
A | 加热放在坩埚中的小块钠 | 钠先熔化成光亮的小球,燃烧时,火焰为黄色,燃烧后,生成淡黄色固体 |
B | 在酒精灯上加热用砂纸打磨过的铝箔 | 铝箔变软,失去光泽,熔化的铝并不滴落 |
C | 在FeCl2溶液中滴入NaOH溶液 | 生成白色沉淀,沉淀很快变为灰绿色,最后变为红褐色 |
D | 将水蒸气通过灼热的铁粉 | 黑色粉末变为红褐色 |
A. A B. B C. C D. D