题目内容
在标准状况下,将537.6L氯化氢气体溶于水配成2L溶液,试计算:
⑴该盐酸的物质的量浓度是多少?
⑵8.7gMnO2与100mL该盐酸反应,生成的气体在标准状况下是多少升?
⑶向反应后的溶液中加入足量的AgNO3溶液,可生成沉淀的物质的量是多少?
⑴该盐酸的物质的量浓度是多少?
⑵8.7gMnO2与100mL该盐酸反应,生成的气体在标准状况下是多少升?
⑶向反应后的溶液中加入足量的AgNO3溶液,可生成沉淀的物质的量是多少?
⑴12mol/L ⑵ 2.24L ⑶1mol
试题分析:(1)盐酸的浓度为
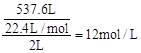 。
。(2) MnO2 + 4HCl(浓)
 MnCl2 + Cl2↑+ 2H2O
MnCl2 + Cl2↑+ 2H2O1mol 4mol 22.4L
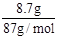 12mol/L×0.1L VL
12mol/L×0.1L VL根据数据可知浓盐酸过量,所以V=2.24L。
(3)溶液中剩下的Cl-有12mol/L×0.1L-
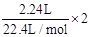 =1mol,则生成AgCl为1mol。
=1mol,则生成AgCl为1mol。点评:本题非常基础,主要根据方程式进行计算。

练习册系列答案
相关题目
