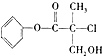
题目内容
【题目】回收铅蓄电池的电极填充物(铅膏,主要含PbO、PbO2、PbSO4),可制备热稳定剂三盐基硫酸铅(组成可表示为3PbOPbSO4H2O),其实验流程如下: 
(1)物质X可以循环利用,该物质是 . 最后一次过滤之后需要洗涤,检验三盐基硫酸铅是否洗净的方法是 .
(2)从滤液A可提取出一种含结晶水的钠盐副产品.若检验该晶体中结晶水的含量,所需的硅酸盐材质仪器有、、、玻璃棒、石棉网、干燥器等.
(3)流程中不直接利用H2SO4溶液与PbO、PbCO3反应制取PbSO4 , 原因可能是 .
(4)生成三盐基硫酸铅的离子反应方程式为 .
(5)向铅膏浆液中加入Na2SO4溶液的目的是将其中的PbO2还原为PbO.若实验中所取铅膏的质量为47.8g,其中PbO2的质量分数为15.0%,则要将PbO2全部还原,至少需加mL 1.0molL﹣lNa2SO3溶液.
【答案】
(1)HNO3溶液;取少量溶液,加入足量稀盐酸,再加氯化钡溶液,观察是否产生白色沉淀
(2)坩埚;酒精灯;泥三角
(3)PbSO4不溶于水,覆盖在固体表面阻碍反应的进一步发生
(4)4PbSO4+6OH﹣=3PbO?PbSO4?H2O+3SO42﹣+2H2O
(5)30
【解析】解:(1)分析流程可知,PbO和PbCO3在硝酸的作用下转化成Pb(NO3).Pb(NO3)中加稀H2SO4转化成PbSO4和硝酸,因此X为HNO3 , 可循环利用,检验硫酸根离子的方法为:取少量晶体溶于蒸馏水,然后用盐酸酸化,再滴BaCl2溶液,若出现白色沉淀,即证明该晶体中含有SO42﹣ , 所以答案是:HNO3溶液;取少量溶液,加入足量稀盐酸,再加氯化钡溶液,观察是否产生白色沉淀;(2)测量晶体中结晶水的含量,实验步骤为:①研磨 ②称量空坩埚和装有试样的坩埚的质量 ③加热 ④冷却 ⑤称量 ⑥重复③至⑤的操作,直到连续两次称量的质量差不超过0.1g为止 ⑦根据实验数据计算晶体中结晶水的含量,所以所需的硅酸盐材质仪器有玻璃棒、石棉网、干燥器、坩埚、酒精灯、泥三角,
所以答案是:坩埚;酒精灯;泥三角;(3)生成的硫酸铅难溶于水,覆盖在固体PbO、PbCO3的表面,阻碍反应的进一步发生,所以答案是:PbSO4不溶于水,覆盖在固体表面阻碍反应的进一步发生;(4)从流程看,硫酸铅和氢氧化钠反应生成三盐基硫酸铅和硫酸钠,反应方程式为:4PbSO4+6NaOH=3PbOPbSO4H2O+3Na2SO4+2H2O,离子方程式为:
4PbSO4+6OH﹣=3PbOPbSO4H2O+3SO42﹣+2H2O,所以答案是:4PbSO4+6OH﹣=3PbOPbSO4H2O+3SO42﹣+2H2O;(5)氧化铅的物质的量为: ![]() =0.03mol,
=0.03mol,
PbO2 ~ | Na2SO3 |
1mol | 1mol |
0.03mol | n |
n=0.03mol,V= ![]() =0.03L=30mL,
=0.03L=30mL,
所以答案是:30.