题目内容
某同学在实验室进行探究实验。(Ⅰ)实验目的:研究铁与浓硫酸的反应
(Ⅱ)实验药品:铁钉(表面无铁锈)、浓硫酸、酸性高锰酸钾溶液、品红溶液、氧化铜、硫酸铜溶液
(Ⅲ)实验装置(按从左到右的方向将A装置与B等装置相连):
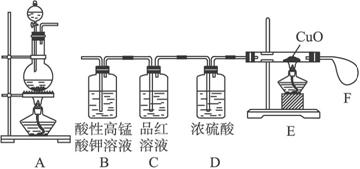
(Ⅳ)实验步骤(请将表中空格补充完整):
实验内容和步骤 | 实验现象 | 结论 |
①连接好装置,检查装置的气密性 |
|
|
②将铁钉加入到烧瓶中,再向其中滴加浓硫酸 | 未见明显现象 | 原因为: ______________ |
③点燃A、E处酒精灯 | 片刻后,烧瓶中溶液有颜色变化,并有气泡产生烧瓶中产生 | 气体的化学方程式为:_____________________ |
(Ⅴ)反思评价
在实验过程中,该同学观察到B装置中溶液颜色逐渐变浅,C装置中溶液颜色未见明显变化。再过一段时间后,E装置中氧化铜粉末由黑色转变为红色,气球F逐渐鼓起,此时C装置中溶液颜色仍未见明显变化。试回答下列问题。
①E装置中氧化铜由黑色变红的原因,可用化学反应方程式表示为:____________________。
②为探究铁钉与浓硫酸在不加热情况下是否发生了反应,请你帮该同学设计实验,填写下表内容:
试剂 | 操作方法 | 现象及结论 |
|
|
|
(Ⅳ)②浓H2SO4在室温时将铁表面氧化生成了一层致密的氧化膜
③2Fe+6H2SO4(浓)![]() Fe2(SO4)3+3SO2↑+6H2O
Fe2(SO4)3+3SO2↑+6H2O
(Ⅴ)①CuO+H2![]() Cu+H2O ②
Cu+H2O ②
试剂 | `操作方法 | 现象和结论 |
①铁钉 ②浓H2SO4 ③CuSO4溶液(1分) | ①将一根洁净的铁钉插入浓H2SO4中,片刻后取出用水洗净; ②再将其与另一根铁钉同时插入CuSO4溶液中(2分) | ①铁钉放入浓H2SO4中无明显变化; ②直接放入CuSO4溶液中的铁钉表面有红色Cu析出,从浓H2SO4中取出的铁钉再放入CuSO4溶液中无红色Cu析出,说明Fe与浓H2SO4发生了反应,被“钝化”(2分) |
解析:Ⅳ②铁遇浓H2SO4发生钝化,故不产生气体。③加热后氧化膜溶于浓H2SO4,Fe与浓H2SO4在加热条件下发生氧化还原反应。Ⅴ①除浓H2SO4变稀产生H2能还原CuO外无其他还原性气体。②该实验本质是检验铁与浓H2SO4在不加热条件下是否钝化。根据所学知识,应钝化,而钝化后表面覆盖了氧化膜而Fe无法直接参加反应,故应选择Fe参加反应有现象而氧化物不参加反应,无现象证明已被钝化,可用Fe置换Cu、Ag等。

 名校课堂系列答案
名校课堂系列答案