题目内容
(1)下列A、B、C、D是中学常见的混合物分离或提纯的基本装置。
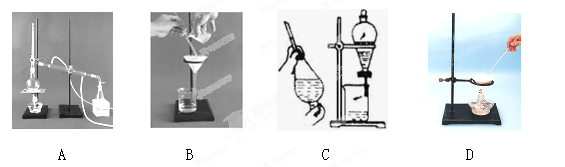 根据混合物分离或提纯的原理,回答在下列实验中需要使用哪种装置(将A、B、C、D填入适当的空格中)。
根据混合物分离或提纯的原理,回答在下列实验中需要使用哪种装置(将A、B、C、D填入适当的空格中)。
①除去Ca(OH)2溶液中悬浮的CaCO3 ; ②从碘水中提取碘 ;
③用自来水制取蒸馏水 ; ④分离植物油和水 ;
⑤除去食盐水中的泥沙 ; ⑥与海水晒盐原理相符的是 。
(2)由可溶性铝盐制取氢氧化铝,需加入的试剂为: ;
离子方程式为: 。
白色的Fe(OH)2在空气中发生的颜色变化为 。
反应的化学方程式为: 。
|
 根据混合物分离或提纯的原理,回答在下列实验中需要使用哪种装置(将A、B、C、D填入适当的空格中)。
根据混合物分离或提纯的原理,回答在下列实验中需要使用哪种装置(将A、B、C、D填入适当的空格中)。①除去Ca(OH)2溶液中悬浮的CaCO3 ; ②从碘水中提取碘 ;
③用自来水制取蒸馏水 ; ④分离植物油和水 ;
⑤除去食盐水中的泥沙 ; ⑥与海水晒盐原理相符的是 。
(2)由可溶性铝盐制取氢氧化铝,需加入的试剂为: ;
离子方程式为: 。
白色的Fe(OH)2在空气中发生的颜色变化为 。
反应的化学方程式为: 。
(1)①B ②C ③A ④C ⑤B ⑥D
(2)氨水(或稀氨水) Al3++3NH3·H2O=Al(OH)3↓+3NH4+
(3)白色迅速变为灰绿色最终变为红褐色4Fe(OH)2+2H2O+O2=4Fe(OH)3
(2)氨水(或稀氨水) Al3++3NH3·H2O=Al(OH)3↓+3NH4+
(3)白色迅速变为灰绿色最终变为红褐色4Fe(OH)2+2H2O+O2=4Fe(OH)3
试题分析:(1)A、B、C、D操作分别为蒸馏、过滤、萃取分液、蒸发。碳酸钙不溶于水,氢氧化钙溶于水,可用过滤的方法除去氢氧化钙溶液中的碳酸钙;碘在水中溶解度不大,在有机溶剂中溶解度大,所以可用四氯化碳或苯萃取碘水中的碘,然后分液;将自来水加热蒸馏,水蒸气冷凝得蒸馏水;植物油与水互不相溶,可用分液法分离;泥沙不溶于水,可用过滤法除去食盐水中的泥沙;海水晒盐的原理是利用太阳、风力等使水分蒸发,氯化钠析出,与蒸发过程相似。(2)氢氧化铝溶于强碱,所以用可溶性铝盐制取氢氧化铝,应用弱碱作沉淀剂,一般用氨水。白色氢氧化亚铁在空气中变成灰绿色最后变成红褐色,氢氧化亚铁与氧气、水生成氢氧化铁。
点评:制氢氧化亚铁时,为便于观察氢氧化亚铁的颜色,一定要避免氧气的存在。所以硫酸亚铁溶液要新制、氢氧化钠溶液需煮沸、胶头滴管要伸入液面以下。

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
 从海水中提取,以下是提取镁的过程中涉及到的几种物质常温下的溶度积常数,根据你所学的知识回答下面的几个问题:?
从海水中提取,以下是提取镁的过程中涉及到的几种物质常温下的溶度积常数,根据你所学的知识回答下面的几个问题:?