题目内容
(2013?重庆二模)铬是一种银白色的坚硬金属,铬的工业用途很广,主要有金属加工、电镀、制革行业,这些行业排放的废水和废气是环境中的主要污染源.请回答下面与铬有关的一些问题.
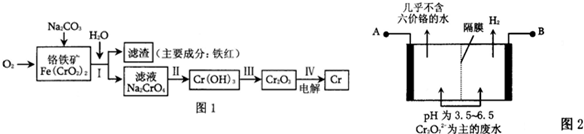
(1)工业上冶炼铬的主要步骤如图1所示:
①已知步骤Ⅱ的反应方程式为:8Na2CrO4+6Na2S+23H2O═8Cr(OH)3↓+3Na2S2O3+22NaOH.该反应中氧化剂是
②步骤IV中电解Cr2O3的阳极反应式为
(2)某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴、阳极,槽中盛放含铬废水,原理示意图如图2,A为电源的
(3)化学需氧量(COD)可量度水体受有机物污染的程度.它是在强酸并加热条件下,用K2Cr2O7作强氧化剂处理水样时所消耗的K2Cr2O7的量,换算成相当于O2的含量(以mg/L计).某研究性学习小组测定某水样的化学需氧量(COD),过程如下:
Ⅰ.取Va mL水样于锥形瓶,加入l0.00mL 0.2500mol/L K2Cr2O7溶液;
Ⅱ.加碎瓷片少许,然后慢慢加入少量硫酸,混合均匀,加热;
Ⅲ.反应完毕后,冷却,加指示剂,用c mol/L的硫酸亚铁铵(NH4)2Fe(SO4)2溶液滴定.终点时消耗硫酸亚铁铵溶液Vb mL(此步操作的目的是用Fe2+把多余的Cr2O72-反应成Cr3+)
①Ⅰ中,量取K2Cr2O7溶液的仪器是
②Ⅱ中,碎瓷片的作用是
③该水样的化学需氧量COD=

(1)工业上冶炼铬的主要步骤如图1所示:
①已知步骤Ⅱ的反应方程式为:8Na2CrO4+6Na2S+23H2O═8Cr(OH)3↓+3Na2S2O3+22NaOH.该反应中氧化剂是
Na2CrO4
Na2CrO4
(填化学式),生成1mol Cr(OH)3时转移电子的物质的量为3
3
mol;②步骤IV中电解Cr2O3的阳极反应式为
2O2--4e-=O2↑
2O2--4e-=O2↑
(2)某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴、阳极,槽中盛放含铬废水,原理示意图如图2,A为电源的
正极
正极
(填“正极”“负极”),阳极区溶液中发生的氧化还原反应为Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
(3)化学需氧量(COD)可量度水体受有机物污染的程度.它是在强酸并加热条件下,用K2Cr2O7作强氧化剂处理水样时所消耗的K2Cr2O7的量,换算成相当于O2的含量(以mg/L计).某研究性学习小组测定某水样的化学需氧量(COD),过程如下:
Ⅰ.取Va mL水样于锥形瓶,加入l0.00mL 0.2500mol/L K2Cr2O7溶液;
Ⅱ.加碎瓷片少许,然后慢慢加入少量硫酸,混合均匀,加热;
Ⅲ.反应完毕后,冷却,加指示剂,用c mol/L的硫酸亚铁铵(NH4)2Fe(SO4)2溶液滴定.终点时消耗硫酸亚铁铵溶液Vb mL(此步操作的目的是用Fe2+把多余的Cr2O72-反应成Cr3+)
①Ⅰ中,量取K2Cr2O7溶液的仪器是
酸式滴定管(或移液管)
酸式滴定管(或移液管)
②Ⅱ中,碎瓷片的作用是
防止暴沸
防止暴沸
③该水样的化学需氧量COD=
8000
| (15-cVb) |
| Va |
8000
(用含c、Va、Vb的表达式表示).| (15-cVb) |
| Va |
分析:(1)①8Na2CrO4+6Na2S+23H2O═8Cr(OH)3↓+3Na2S2O3+22NaOH中,Cr元素的化合价由+6价降低为+3价,生成1mol Cr(OH)3时转移电子1mol×(6-3);
②步骤IV中电解Cr2O3的阳极反应为氧离子失去电子生成氧气;
(2)由图可知,B端生成氢气,则B端氢离子得到电子,所以B为负极,则A为正极;阳极发生Cr2O72-、Fe2+的氧化还原反应,所以阳极几乎不含Cr2O72-;
(3)①K2Cr2O7溶液具有氧化性;
②碎瓷片可防止液体剧烈沸腾;
③由电子守恒可知,1mol废液中失去的电子为
,再由电子守恒转化为相当于O2的含量,以此来解答.
②步骤IV中电解Cr2O3的阳极反应为氧离子失去电子生成氧气;
(2)由图可知,B端生成氢气,则B端氢离子得到电子,所以B为负极,则A为正极;阳极发生Cr2O72-、Fe2+的氧化还原反应,所以阳极几乎不含Cr2O72-;
(3)①K2Cr2O7溶液具有氧化性;
②碎瓷片可防止液体剧烈沸腾;
③由电子守恒可知,1mol废液中失去的电子为
| [10×0.25×2×(6-3)-c×Vb]×10-3 |
| Va×10-3 |
解答:解:(1)①8Na2CrO4+6Na2S+23H2O═8Cr(OH)3↓+3Na2S2O3+22NaOH中,Cr元素的化合价由+6价降低为+3价,则Na2CrO4为氧化剂,该反应中生成1mol Cr(OH)3时转移电子1mol×(6-3)=3mol,故答案为:Na2CrO4;3;
②步骤IV中电解Cr2O3的阳极反应为氧离子失去电子生成氧气,该阳极反应为2O2--4e-=O2↑,故答案为:2O2--4e-=O2↑;
(2)由图可知,B端生成氢气,则B端氢离子得到电子,所以B为负极,则A为正极;阳极发生Cr2O72-、Fe2+的氧化还原反应,所以阳极几乎不含Cr2O72-;,则阳极的氧化还原反应为Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,故答案为:正极;Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;
(3)①K2Cr2O7溶液具有氧化性,则量取K2Cr2O7溶液的仪器为酸式滴定管(或移液管),故答案为:酸式滴定管(或移液管);
②碎瓷片可防止液体剧烈沸腾,其作用为防止暴沸,故答案为:防止暴沸;
③由I可知废水与K2Cr2O7溶液发生氧化还原反应,由Ⅲ可知Fe2+把多余的Cr2O72-反应成Cr3+,由电子守恒可知,1mol废液中失去的电子为
=
,
由电子守恒转化为相当于O2的含量n(O2)=
mol,
则COD=
mol×32g/mol×1000mg/L=8000
,故答案为:8000
.
②步骤IV中电解Cr2O3的阳极反应为氧离子失去电子生成氧气,该阳极反应为2O2--4e-=O2↑,故答案为:2O2--4e-=O2↑;
(2)由图可知,B端生成氢气,则B端氢离子得到电子,所以B为负极,则A为正极;阳极发生Cr2O72-、Fe2+的氧化还原反应,所以阳极几乎不含Cr2O72-;,则阳极的氧化还原反应为Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,故答案为:正极;Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;
(3)①K2Cr2O7溶液具有氧化性,则量取K2Cr2O7溶液的仪器为酸式滴定管(或移液管),故答案为:酸式滴定管(或移液管);
②碎瓷片可防止液体剧烈沸腾,其作用为防止暴沸,故答案为:防止暴沸;
③由I可知废水与K2Cr2O7溶液发生氧化还原反应,由Ⅲ可知Fe2+把多余的Cr2O72-反应成Cr3+,由电子守恒可知,1mol废液中失去的电子为
| [10×0.25×2×(6-3)-c×Vb]×10-3 |
| Va×10-3 |
| 15-cVb |
| Va |
由电子守恒转化为相当于O2的含量n(O2)=
| 15-cVb |
| 4Va |
则COD=
| 15-cVb |
| 4Va |
| (15-cVb) |
| Va |
| (15-cVb) |
| Va |
点评:本题为综合题,以废水的处理考查氧化还原反应、电化学及物质成分的测定,题目难度较大,注意电子守恒再解答中的重要作用,COD的计算为易错点.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目