题目内容
(附加题1)用1 L 1.0 mol/LNaOH溶液吸收35.2 g CO2气体,溶液中CO32-与HCO3-的物质的量之比为1∶3;反应的化学方程式为_______________________________________。
【答案】
5NaOH + 4CO2= 3NaHCO3 + Na2CO3 + H2O
【解析】35.2 g CO2气体是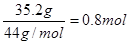 ,氢氧化钠是1.0mol
,氢氧化钠是1.0mol
即二者的物质的量之比是4︰5,而溶液中CO32-与HCO3-的物质的量之比为1∶3
所以方程式为5NaOH + 4CO2= 3NaHCO3 + Na2CO3 + H2O。

练习册系列答案
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案
相关题目
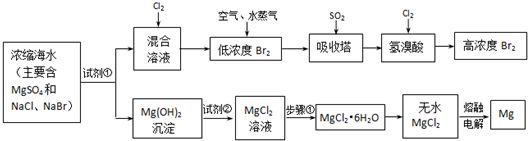
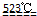 MgO+2 HCl↑+5H2O↑
MgO+2 HCl↑+5H2O↑
