题目内容
3.实验室中所用的氯气是用加热方法制取的:4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+MnCl2+2H2O
一次实验中,用过量的浓盐酸(其密度为1.19g•mL-1、HCl的质量分数为36.5%)跟一定量的MnO2反应,产生了5.6L(标准状况下)的氯气.试计算:
(1)浓盐酸的物质的量浓度;
(2)被氧化的HCl的物质的量;
(3)MnO2的质量.
分析 (1)浓盐酸物质的量浓度=$\frac{1000ρω}{M}$;
(2)根据Cl原子守恒计算被氧化HCl的物质的量;
(3)根据氯气和二氧化锰之间关系式计算二氧化锰质量.
解答 解:(1)浓盐酸物质的量浓度=$\frac{1000ρω}{M}$=$\frac{1000×1.19×36.5%}{36.5}$mol/L=11.9mol/L,
答:浓盐酸的物质的量浓度是11.9mol/L;
(2)n(Cl2)=$\frac{5.6L}{22.4L/mol}$=0.25mol,根据Cl原子守恒得被氧化n(HCl)=2n(Cl2)=2×0.25mol=0.5mol,
答:被氧化的氯化氢物质的量为0.5mol;
(3)根据氯气和二氧化锰之间关系式得消耗二氧化锰质量=$\frac{0.25mol}{1}×1×126g/mol$=31.5g,
答:消耗二氧化锰质量为31.5g.
点评 本题考查化学方程式的有关计算,为高频考点,侧重考查学生分析计算能力,难点是盐酸物质的量浓度计算,注意原子守恒及化学式的灵活运用.

练习册系列答案
相关题目
13.下列实验方案设计中,可行的是( )
| A. | 碘和四氯化碳形成的溶液可以用蒸馏的方法来分离 | |
| B. | 用萃取的方法分离汽油和煤油 | |
| C. | 用溶解和过滤的方法分离硝酸钾和氯化钠固体混合物 | |
| D. | 将O2和H2的混合气体通过灼热的氧化铜,以除去其中的H2 |
14.下列文字表述与反应方程式对应且正确的是( )
| A. | 苯制备硝基苯: | |
| B. | 用醋酸除去水垢:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| C. | 乙醇通入热的氧化铜中:CH3CH2OH+CuO$\stackrel{△}{→}$CH3CHO+Cu+H2O | |
| D. | 实验室用液溴和苯在催化剂作用下制溴苯: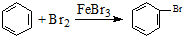 |
11.下列关于热化学反应的描述中正确的是( )
| A. | 已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,则:2H+(aq)+SO${\;}_{\;}^{2-}4$(aq)+Ba2+(aq)+2OH-(aq)═BaSO4(s)+2H2O(l)△H=-114.6 kJ•mol-1 | |
| B. | 燃料电池中将甲醇蒸气转化为氢气的热化学方程式是:CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)△H=-192.9 kJ•mol-1, 则CH3OH(g)的燃烧热为192.9 kJ•mol-1 | |
| C. | H2(g)的燃烧热是285.8 kJ•mol-1,则2H2O(g)═2H2(g)+O2(g)△H=+571.6 kJ•mol-1 | |
| D. | 葡萄糖的燃烧热是2 800 kJ•mol-1,则$\frac{1}{2}$C6H12O6(s)+3O2(g)═3CO2(g)+3H2O(l)△H=-1 400 kJ•mol-1 |
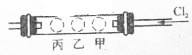 如图所示,有一个硬质玻璃管两端郡装有带导管的单孔塞,在试管中的右、中、左三个部位,分别放入浸有KI淀粉溶液的甲球、浸有NaI浓溶液的乙球和浸有KBr浓溶液的丙球.实验时,从右端缓慢通人C12,同时在乙处微微加热,并将热源从乙向丙处慢慢移动,观察到的现象是:
如图所示,有一个硬质玻璃管两端郡装有带导管的单孔塞,在试管中的右、中、左三个部位,分别放入浸有KI淀粉溶液的甲球、浸有NaI浓溶液的乙球和浸有KBr浓溶液的丙球.实验时,从右端缓慢通人C12,同时在乙处微微加热,并将热源从乙向丙处慢慢移动,观察到的现象是: