题目内容
【题目】氨是最重要的氮肥,是产量最大的化工产品之一。其合成原理为:N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92.4kJ·mol-1。在密闭容器中,使2molN2和6molH2混合发生上述反应:
2NH3(g) ΔH=-92.4kJ·mol-1。在密闭容器中,使2molN2和6molH2混合发生上述反应:
(1)当反应达到平衡时,N2和H2的浓度比是____;N2和H2的转化率比是____。
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量___________,密度______。(填“变大”“变小”或“不变”)。
(3)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将_____(填“向左移动”“向右移动”或“不移动”)。达到新平衡后,容器内温度_____(填“大于”“小于”或“等于”)原来的2倍。
【答案】1:3 1:3 减小 不变 向左移动 小于
【解析】
(1)加入的氮气和氢气的物质的量之比等于其化学计量数之比;
(2)由质量守恒定律可知混合气体质量不变,升高温度,平衡逆向移动;
(3)升高温度,平衡逆向移动,使体系温度降低。
(1)加入的氮气和氢气的物质的量之比等于其化学计量数之比,无论反应到什么程度,用氮气和氢气表示的速率正比等于化学计量数之比,所以氮气和氢气的浓度之比始终是1:3,转化率之比为1:1,故答案为:1:3;1:1;
(2)由质量守恒定律可知混合气体质量不变,升高温度,平衡逆向移动,气体物质的量增大,则气体的平均相对分子质量减小;因容器体积没变,气体质量不变,所以密度不变,故答案为:变小;不变;
(3)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,升高温度,平衡逆向移动,使体系温度降低,则达到新平衡后,容器内温度小于原来的2倍,故答案为:向左移动;小于。

 名校课堂系列答案
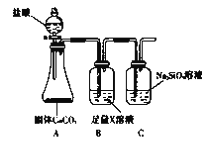
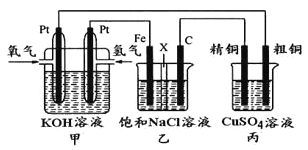
名校课堂系列答案【题目】在呼吸面具和潜水艇中可用过氧化钠作为供氧剂。请选用适当的化学试剂和实验用品、用下图中的实验装置进行实验,证明过氧化钠可作供氧剂。

(1)A是制取CO2的装置。写出A中发生反应的方程式______________。
(2)填写表中空格:
仪器 | 加入试剂 | 加入该试剂的目的 |
B | 饱和NaHCO3溶液 | _________ |
C | _________ | _________ |
D | _________ | _________ |
(3)写出过氧化钠与二氧化碳反应的化学方程式:__________。
(4)某课外小组为了验证Na2CO3和NaHCO3的稳定性,设计了如图所示的实验装置,你认为在试管B中应放的物质是_______,C、D两个烧杯中的溶液分别是______、_______,Na2CO3粉末中混有少量NaHCO3,除去杂质的方法(写方程式)________。