题目内容
【题目】Ⅰ.(1)室温下,pH=3的CH3COOH溶液加水稀释到原体积的10倍,溶液的pH值范围_____;
(2)室温下,pH=1和pH=3的硫酸等体积混合后溶液的pH=_____(lg2=0.3、lg3=0.477、lg5=0.7)
(3)在25℃时,100ml 0.6mol/L的盐酸与等体积0.4mol/L的氢氧化钠溶液混合后,溶液pH=______
Ⅱ.某烧碱样品含少量不与酸作用的杂质,为了测定其纯度,进行以下滴定操作:
A.在250 mL的容量瓶中定容配成250 mL烧碱溶液
B.用移液管移取25 mL烧碱溶液于锥形瓶中并滴几滴指示剂甲基橙
C.在天平上准确称取烧碱样品Wg,在烧杯中用蒸馏水溶解
D.将物质的量浓度为c的标准盐酸溶液装入酸式滴定管调节液面,记下开始读数为V1
E.在锥形瓶下垫一张白纸,滴定至终点,记下读数V2
回答下列各问题:
(1)正确操作步骤的顺序是(用字母填写)_____→_____→_____→D→_____。
(2)D步骤中尖嘴部分应_____________________。
(3)滴定终点时锥形瓶中颜色变化____________。
(4)若酸式滴定管不用标准盐酸润洗,在其他操作均正确的前提下,会对测定结果(指烧碱的纯度)有何影响?_____(填“偏高”、“偏低”或“不变”)
【答案】3<pH<4 1.3 1 C A B E 排净气泡,充满液体 由黄色变为橙色 偏高
【解析】
Ⅰ.(1)pH=a的弱酸,加水稀释到原来体积的10b倍,由于加水稀释时对其电离平衡有促进作用,故其a<pH<(a+b);
(2)pH=1和pH=3的硫酸中c(H+)分别为:0.1mol·L-1、10-3 mol·L-1,先计算混合溶液中c(H+),再根据pH计算方法计算混合溶液的pH;
(3)在25℃时,100ml 0.6mol/L的盐酸与等体积0.4mol/L的氢氧化钠溶液混合后,n(碱)<n(酸),所以酸过量,溶液显示酸性,求混合溶液中c(H+);
Ⅱ.实验时应先称量一定质量的固体,溶解后配制成溶液,量取待测液于锥形瓶中,然后用标准液进行滴定,结合滴定操作的注意事项进行解答.
Ⅰ.(1)根据弱酸的稀释规律:pH=a的弱酸,加水稀释到原来体积的10b倍,由于加水稀释时对其电离平衡有促进作用,故其a<pH<(a+b),室温下,pH=3的CH3COOH溶液加水稀释到原体积的10倍,溶液的pH值范围:3<pH<4 ;
(2)pH=1和pH=3的硫酸中c(H+)分别为:0.1mol·L-1、10-3 mol·L-1,先计算混合溶液中c(H+)=![]() mol·L-1,混合液的pH=-lg
mol·L-1,混合液的pH=-lg![]() ≈1+lg2=1.3;
≈1+lg2=1.3;
(3)在25℃时,100ml 0.6mol/L的盐酸与等体积0.4mol/L的氢氧化钠溶液混合后,n(碱)<n(酸),所以酸过量,溶液显示酸性,求混合溶液中c(H+)=![]() mol·L-1=0.1mol·L-1,所以混合液的pH=-lg0.1=1;
mol·L-1=0.1mol·L-1,所以混合液的pH=-lg0.1=1;
Ⅱ.(1)实验时应先称量一定质量的固体,溶解后配制成溶液,量取待测液于锥形瓶中,然后用标准液进行滴定,故答案为:C;A;B;E;
(2)D步骤中尖嘴部分应充满液体,无气泡。
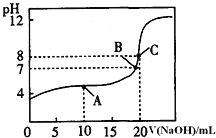
(3)指示剂为甲基橙,变色范围为 3.1~4.4,终点时pH约为4.4,滴定终点时锥形瓶中颜色变化:颜色由黄色变为橙色。
(4)若酸式滴定管不用标准盐酸润洗,在其他操作均正确的前提下,因标准液浓度变小,用量变大,测定结果偏高.