题目内容
足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,将这些气体与1.68LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5mol/LNaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是
| A.60 ml | B.45 ml. | C.30 mL | D.15mL |
A
解析试题分析:1.68L的氧气的物质的量是0.075mol,铜与硝酸反应产生的气体与氧气反应溶于水生成硝酸,相当于铜与氧气反应,根据得失电子守恒得0.075mol氧气得电子的物质的量是0.3mol,所以有0.3mol/2=0.15molCu参加反应,因此需要氢氧化钠的物质的量是0.3mol,需要5mol/LNaOH溶液的体积是0.3mol/5mol/L=0.06L=60ml,答案选A。
考点:考查氧化还原反应的计算,得失电子守恒规律的应用

某合金(仅含铜、铁)中铜和铁的物质的量之和为ymol,其中Cu的物质的量分数为a ,将其全部投入50mLbmol·L-1的硝酸溶液中,加热使其充分反应(假设NO是唯一的还原产物)。下列说法不正确的是
| A.若金属有剩余,在溶液中再滴入硫酸后,金属又开始溶解 |
| B.若金属全部溶解,则溶液中不一定含有Fe3+ |
| C.若金属全部溶解,且产生336mL气体(标准状况),则b=0.3 |
| D.当溶液中金属离子只有Fe3+、Cu2+时,则a与b的关系为:b≥80y(1-a/3) |
矿石中金的含量很低,金的性质又相当稳定,只能用湿法冶金——氰化法提炼,即采用稀的NaCN溶液处理已粉碎的矿石,把少量的金浸入溶液中,然后用金属锌作还原剂将金从溶液中置换析出。其反应原理为
①4Au+8NaCN+O2+2H2O 4Na[Au(CN)2]+4NaOH;
4Na[Au(CN)2]+4NaOH;
②2Na[Au(CN)2]+Zn 2Au+Na2[Zn(CN)4]。
2Au+Na2[Zn(CN)4]。
以下有关氰化法提炼金的说法中正确的是( )
| A.Na[Au(CN)2]不溶于水 |
| B.化合物Na[Au(CN)2]中金元素的化合价为+1 |
| C.金元素在地壳中能以化合态的形式存在 |
| D.在提炼过程中含金元素的物质始终作氧化剂 |
今有下列三个氧化还原反应:
①2FeCl3+2KI===2FeCl2+2KCl+I2
②2FeCl2+Cl2===2FeCl3
③2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O
若某溶液中有Fe2+、I-、Cl-共存,要除去I-而不氧化Fe2+和Cl-,则可加入的试剂是
| A.Cl2 | B.KMnO4 | C.HCl | D.FeCl3 |
下列试剂不会因为空气中的氧气而变质的是
| A.过氧化钠 | B.氢硫酸 | C.硫酸亚铁 | D.苯酚 |
实验室将NaClO3和Na2SO3按物质的量为2:1放入烧杯中,同时滴入适量H2SO4,并用水浴加热,产生棕黄色的气体X,反应后测得NaClO3和Na2SO3恰好完全反应,则X的化学式为
| A.Cl2 | B.Cl2O | C.ClO2 | D.Cl2O3 |
下列关于甲、乙、丙、丁四个图像的说法中,正确的是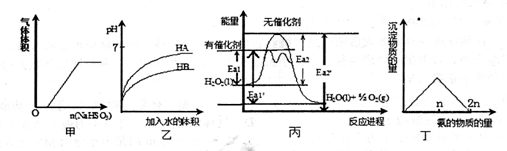
| A.甲是亚硫酸氢钠粉末投入稀硝酸溶液中有关图像 |
| B.乙是等pH的HA和HB两种弱酸溶液稀释时pH变化图,由此可知HA的酸性弱于HB |
| C.由丙可知,双氧水在有催化剂存在时的热化学方程式为 2H2O2(1)="2H" 2O(l)+O2(g) △H=-2(Ea2’-Ea2) kJ·mol-l |
| D.丁是向硝酸银溶液中滴加氨水时,沉淀质量与氨的物质的量的关系图 |
FeS与一定浓度的HNO3反应,生成Fe(NO3)3、Fe2(SO4)3、NO2、N2O4、NO和H2O,当NO2、N2O4、NO的物质的量之比为1:1:1时,实际参加反应的FeS与HNO3的物质的量之比为
| A.1:6 |
| B.2:15 |
| C.2:11 |
| D.1:7 |
被称为万能还原剂的NaBH4溶于水并和水反应:NaBH4+2H2O=NaBO2+4H2↑,下列说法中正确的是(NaBH4中H为-1价)
| A.NaBH4既是氧化剂又是还原剂 |
| B.NaBH4是氧化剂,H2O是还原剂 |
| C.硼元素被氧化,氢元素被还原 |
| D.被氧化的元素与被还原的元素质量之比为1∶1 |