题目内容
(1)某化学兴趣小组的同学进行Cl2、NH3的制备及性质检验等实验的流程和部分装置如下:
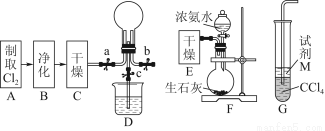
①请利用A、G装置设计一个简单的实验验证Cl2、Fe3+、I2的氧化性强弱为Cl2>Fe3+>I2(实验中不断地小心振荡G装置中的试管)。请写出A中发生反应的离子方程式:______________________________________________,
请写出试剂M为________溶液,证明氧化性为Cl2>Fe3+>I2的实验现象是________________________________________________________________________。
②已知3Cl2+2NH3=6HCl+N2,当D的烧瓶中充满黄绿色气体后,关闭a、c打开b,D中的现象为黄绿色气体消失,产生白烟,反应一段时间后,关闭b打开c,观察到的现象为________________________________________________________________________。
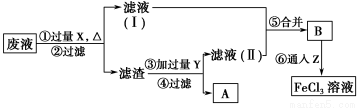
(2)某废水中含有一定量的Na+、SO32—,可能含有CO32—,某研究小组欲测定其中SO32—的浓度,设计如下实验方案:
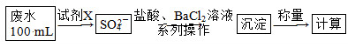
①从下列试剂中选择试剂X为________(填序号);
A.0.1 mol/L KMnO4(H2SO4酸化)溶液 B.0.5 mol/L NaOH溶液
C.新制氯水 D.KI溶液
②加入试剂X生成SO42—的离子方程式为_______________________________________
③证明该废水中是否含有CO32—的实验方案为_________________________________________________
(1)①MnO2+4H++2Cl- Mn2++Cl2↑+2H2O FeI2 先观察到下层CCl4由无色变为紫红色,后看到上层溶液由浅绿色变为黄色
Mn2++Cl2↑+2H2O FeI2 先观察到下层CCl4由无色变为紫红色,后看到上层溶液由浅绿色变为黄色
②烧杯中的液体进入烧瓶中,形成喷泉
(2)①C
②Cl2+SO32—+H2O=2Cl-+SO42—+2H+
③向废水中加入足量的盐酸,将生成的气体先通入足量的酸性KMnO4溶液,再通入澄清石灰水,若紫色酸性KMnO4溶液颜色变浅,石灰水变浑浊,则证明废水中含有CO2
【解析】(1)①根据题中所给装置,要证明氧化性Cl2>Fe3+>I2,可将氯气通入试剂M(FeI2溶液)中,由Cl2先后将I-和Fe2+氧化为I2和Fe3+,可得出结论。I2的生成可由CCl4层出现紫色看出,而Fe3+的生成可由上层溶液变成黄色看出。②反应生成的HCl极易溶于水,可形成喷泉。
(2)由题中流程图看出测定原理为:利用氧化剂将SO32—氧化为SO42—,再加入BaCl2将其沉淀为BaSO4,加入盐酸酸化的目的是排除CO32—的干扰,硫酸酸化的KMnO4溶液中含有SO42—,会干扰实验,故可用新制氯水来氧化SO32—