题目内容
足量的镁与一定质量的盐酸反应,由于反应速率太快,若要减慢反应速率,但不能影响产生氢气的总质量,可以加入的物质是
| A.CuSO4 | B.NaOH | C.K2CO3 | D.CH3COONa |
D
试题分析:根据发生的反应为Mg+2H+═Mg2++H2↑,则减小氢离子的浓度而不改变氢离子的物质的量即可满足减慢反应速率,但又不影响产生氢气的总量,
A项:加入CuSO4,构成Mg、Cu、盐酸原电池,加快反应速率,故错;
B、C项:都与氢离子反应,影响氢气的总质量,故错;
D项:CH3COO-和H+生成弱电解质CH3COOH,是溶液中H+数目暂时减少,反应速率就减慢,随着反应的进错,H+减少,CH3COOH会电离出H+,直到反应结束。
故选D。
点评:本题以化学反应来考查影响反应速率的因素,明确氢离子浓度减小是减慢反应速率的关系。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
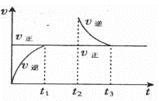
 X(g)+Y(?) ΔH>0 ,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件。下列有关说法中不正确的是( )
X(g)+Y(?) ΔH>0 ,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件。下列有关说法中不正确的是( )