题目内容
【题目】甲醇是重要的化工原料,又是一种可再生能源,具有广泛的开发和应用前景。
(1)已知反应CO(g)+2H2(g) ![]() CH3OH(g)H=-99kJ.mol-1中的相关化学键键能如下:
CH3OH(g)H=-99kJ.mol-1中的相关化学键键能如下: 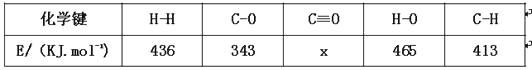
则x=。
(2)在一容积可变的密闭容器中,1molCO与2molH2发生反应:CO(g)+2H2(g) ![]() CH3OH(g) H1<0,CO在不同温度下的平衡转化率(α)与压
CH3OH(g) H1<0,CO在不同温度下的平衡转化率(α)与压
强的关系如下图所示。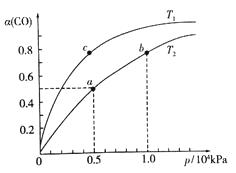
①a、b两点的反应速率:v(a)v(b)(填“>”“<”或“=”)。
②T1T2(填“>”“<”或“=”),原因是。
③在c点条件下,下列叙述能说明上述反应能达到化学平衡状态的是(填代号)
a.H2的消耗速率是CH3OH生成速率的2倍 b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变 d.CO和CH3OH的物质的量之和保持不变
④图中a点的平衡常数KP=(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)利用合成气(主要成分为CO和H2)合成甲醇,发生主要反应如下:I:CO(g)+2H2(g) ![]() CH3OH(g) H1II:CO2(g)+H2(g)
CH3OH(g) H1II:CO2(g)+H2(g) ![]() CO(g) + H2O(g) H2III:CO2(g)+3H2(g)
CO(g) + H2O(g) H2III:CO2(g)+3H2(g) ![]() CH3OH(g) + H2O(g) H3
CH3OH(g) + H2O(g) H3
上述反应对应的平衡常数分别为K1、K2、K3 , 它们随温度变化曲线如下图所示。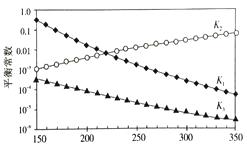
则H1H3(填“>”、“<”、“=”), 理由是。
【答案】
(1)1076
(2)<;<;CO(g)+2H2(g) ![]() CH3OH(g)是放热反应,温度升高,平衡逆向移动,CO的平衡转化率减小,故Tl<T2;bc;1.6×10-7(或 1.6×10-13)
CH3OH(g)是放热反应,温度升高,平衡逆向移动,CO的平衡转化率减小,故Tl<T2;bc;1.6×10-7(或 1.6×10-13)
(3)<;由图可知,随着温度升高,K2减小,则△H2>0,根据盖斯定律又得△H3=△H1+△H2 , 所以△H1<△H3
【解析】解:(1)反应焓变=反应物键能总和-生成物键能总和,即CO(g)+2H2(g)CH3OH(g),x+2×436-413×3-343-465=-99,解之得x=1076,所以答案是:1076;
(2)①压强越大反应速率越快,所以a、b两点的反应速率:v(a)<v(b),所以答案是:<;
②压强相同时一氧化碳的转化率高,所以平衡正向移动,而正反应是放热反应,温度升高,平衡逆向移动,CO的平衡转化率减小,故Tl<T2 , 所以答案是:<;
而正反应是放热反应,温度升高,平衡逆向移动,CO的平衡转化率减小,故Tl<T2;
③a.只要反应发生就有H2的消耗速率是CH3OH生成速率的2倍,故错误;
b.CH3OH的体积分数不再改变,说明各物质的量不变,反应达平衡状态,故正确;
c.混合气体的密度不再改变,说明气体的物质的量不变,反应达平衡状态,故正确;
d.CO和CH3OH的物质的量之和保持不变,可能平衡也可能未平衡,故错误;
故选bc;
④a点的一氧化碳转化率为50%,总压为0.5MPa,
CO(g)+2H2(g)CH3OH(g)
起始量(mol) 1 2 0
变化量(mol) x 2x x
平衡量(mol) 1-x 2-2x x
而一氧化碳转化率为50%,所以x=0.5mol,Kp═ =1.6×10-7 (kPa)-2 , 所以答案是:1.6×10-7 (kPa)-2;
=1.6×10-7 (kPa)-2 , 所以答案是:1.6×10-7 (kPa)-2;
(3)由图l可知,随着温度升高,K1减小,则反应1:CO2(g)+H2(g)CO(g)+H2O(g)△H1<0,反应3由反应1+2所得,根据盖斯定律:△H3=△H1+△H2 , 所以△H2>△H3 ,
所以答案是:>;曲图l可知,随着温度升高,K1减小,则△H1<0,根据盖斯定律又得△H3=△H1+△H2 , 所以△H2>△H3 .
【考点精析】关于本题考查的化学平衡状态本质及特征和化学平衡状态的判断,需要了解化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效);状态判断:①v(B耗)=v(B生)②v(C耗):v(D生)=x : y③c(C)、C%、n(C)%等不变④若A、B、C、D为气体,且m+n≠x+y,压强恒定⑤体系颜色不变⑥单位时间内某物质内化学键的断裂量等于形成量⑦体系平均式量恒定(m+n ≠ x+y)等才能得出正确答案.

【题目】已知:KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O.如图所示,将少量试剂分别放入培养皿中的相应位置,实验时将浓盐酸滴在KClO3晶体上,并用表面皿盖好.下表中由实验现象得出的结论完全正确的是( )
选项 | 实验现象 | 结论 |
A | 滴有KSCN的FeCl2溶液变红 | Cl2具有还原性 |
B | 滴有酚酞的NaOH溶液褪色 | Cl2具有酸性 |
C | 石蕊试液先变红后褪色 | Cl2具有漂白性 |
D | KI淀粉溶液变蓝 | Cl2具有氧化性 |

A.A
B.B
C.C
D.D