题目内容
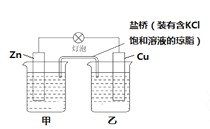
【题目】(1)已知Zn+CuSO4=Cu+ZnSO4,设计成原电池,构造如图所示,试问CuSO4溶液放在 (填“甲”或“乙”)烧杯,盐桥中的Cl-移向 (填“甲”或“乙”)烧杯;
(2)已知①C(s)+ O2(g ) = CO2(g) ΔH=-393.5kJ/mol
②CO(g)+ ![]() O2(g) = CO2(g) ΔH=-283.0kJ/mol
O2(g) = CO2(g) ΔH=-283.0kJ/mol
请写出C转化为CO的热化学方程式: 。
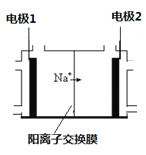
(3)电解饱和食盐水是重要的化工产业,它被称为“氯碱工业”。在教材《化学1》、《化学2》、《化学反应原理》中均有提及,请写出电解饱和食盐水的化学反应方程式 ,其中右图是《化学反应原理》中电解饱和食盐水工业中所采用的离子交换膜电解槽示意图,部分图标文字已被除去,请根据图中残留的信息(通电以后Na+的移动方向)判断电极2的名称是 ,并写出电极1的电极反应式 。
【答案】(12分)(1)乙,甲 ;(2)C(s)+ ![]() O2(g) = CO(g) ΔH=-110.5kJ/mol
O2(g) = CO(g) ΔH=-110.5kJ/mol
(3)2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑ 阴极,2Cl--2e-=Cl2↑ 。
2NaOH+H2↑+Cl2↑ 阴极,2Cl--2e-=Cl2↑ 。
【解析】
(1)将反应Zn+CuSO4=Cu+ZnSO4设计成原电池,在甲烧杯放热ZnSO4溶液,在乙烧杯中放入CuSO4溶液,Zn电极是负极,失去电子,形成阳离子,电极反应是Zn-2e-=Zn2+,Cu电极是正极,发生的电极反应式是Cu2++2e-=Cu,根据同种电荷相互排斥,异种电荷相互吸引的原则,Cl-向正电荷较多的负极区移动,即向甲烧杯中定向移动;(2)①-②,整理可得C(s)+ ![]() O2(g) = CO(g) ΔH=-110.5kJ/mol;(3)电解饱和食盐水,在阳极发生反应是:2Cl--2e-=Cl2↑,在阴极发生的电极反应是“2H++2e-=H2↑,总化学反应方程式是2NaCl+2H2O
O2(g) = CO(g) ΔH=-110.5kJ/mol;(3)电解饱和食盐水,在阳极发生反应是:2Cl--2e-=Cl2↑,在阴极发生的电极反应是“2H++2e-=H2↑,总化学反应方程式是2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑;根据同种电荷相互排斥,异种电荷相互吸引的原则,根据Na+由电极1区向电极2区移动,可知电极2的名称是阴极,电极1是阳极,电极1的电极反应式是2Cl--2e-=Cl2↑ 。
2NaOH+H2↑+Cl2↑;根据同种电荷相互排斥,异种电荷相互吸引的原则,根据Na+由电极1区向电极2区移动,可知电极2的名称是阴极,电极1是阳极,电极1的电极反应式是2Cl--2e-=Cl2↑ 。


