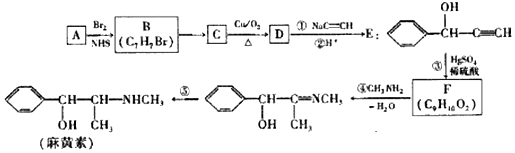
��Ŀ����
����Ŀ��H7N9����������һ�����������У��о��������ò����������У����2�������ϼ���ʧȥ���ԣ����ೣ������ҩ������������ء�Ư�ۡ������ȣ�Ҳ�����Խ��ò���ɱ��
��1��������ˮ�к��ж�����������ɫʯ����Һ������ˮ�У���Һ�Ժ�ɫ�����õ�����____����һ�������Һ��ɫ����ȥ�������õ�����______��
��2����ҵ����ȡƯ�۵ķ�Ӧ����ʽΪ��___________��
��3����֪���������Ũ�������ܲ�����������ѧ��Ӧ����ʽΪ��2KMnO4 +16HCl ![]() 2MnCl2+2KCl+8H2O+5Cl2��
2MnCl2+2KCl+8H2O+5Cl2��
�÷�Ӧ��������Ϊ________������˫���ŷ���ʾ����ת�Ƶ������_________________
��4����Ư����Һ�еμ�̼������Һ���а�ɫ�������ɣ�д��������Ӧ�����ӷ���ʽ___��
��5������������ͨ��FeBr2��Һ�У�д���÷�Ӧ�����ӷ���ʽ__________��
���𰸡� H+ HClO 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O KMnO4 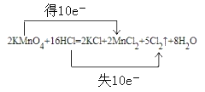 Ca2++CO32+=CaCO3�� 2Fe2++4Br����3Cl2��2Fe3++2Br2+6Cl��
Ca2++CO32+=CaCO3�� 2Fe2++4Br����3Cl2��2Fe3++2Br2+6Cl��
�������������������1����ˮ����������ˮ�õ���ˮ��Һ����ˮ����H����Cl����Cl2��HClO��H2O�ȶ�����������ɫʯ����Һ������ˮ�У���Һ�Ժ�ɫ�����õ�����H������һ�������Һ��ɫ����ȥ�������õ�����HClO��
��2����ҵ����������ʯ���鷴Ӧ����ȡƯ�ۣ���ѧ����ʽΪ2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O��
��3�����ݻ�ѧ��Ӧ��MnԪ�صĻ��ϼ���+7�۽��͵�+2�ۣ��õ��ӷ�����ԭ��Ӧ�����Ը÷�Ӧ��������ΪKMnO4����˫���ŷ���ʾ�ĵ���ת��������£�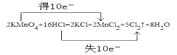 ��
��
��4��Ư�۾�����CaCl2��Ca(ClO)2��CaCl2������Na2CO3��Ӧ���ɰ�ɫ��������Ӧ�����ӷ���ʽΪCa2++CO32+=CaCO3����
��5����������ǿ�����ԣ��ܽ�Fe2����Br��������Fe3����Br2�����Խ���������ͨ��FeBr2��Һ�з�Ӧ�����ӷ���ʽΪ2Fe2++4Br����3Cl2��2Fe3++2Br2+6Cl����