题目内容
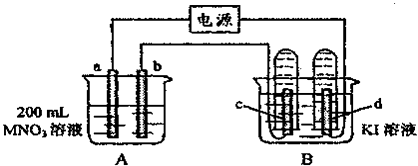
【题目】重铬酸钾(K2Cr2O7)具有强氧化性,是一种重要的化工原料,广泛应用于制革、印染、电镀等工业。以铬酸钾(K2CrO4)和氢氧化钾为原料,用电化学法制备重铬酸钾的实验装置如图所示。已知水溶液中存在平衡:2CrO42-+2H+![]() Cr2O72-+H2O。下列说法中正确的是
Cr2O72-+H2O。下列说法中正确的是

A. 气体甲和乙分别为O2和H2
B. 该装置中阴极区的pH减小
C. Fe电极反应式4OH--4e-=O2↑+2H2O
D. 当铬酸钾的转化率达到80%时,右池中![]() =
=
【答案】D
【解析】根据原理和装置图可知,图中右池中产生H+,所以推断出C电极为阳极,阳极电极反应式为![]() ;
;![]() 电极为阴极,阴极电极反应式为
电极为阴极,阴极电极反应式为![]() 。A项,气体甲和乙应分别为H2和O2,故A项错误;B项,阴极区产生
。A项,气体甲和乙应分别为H2和O2,故A项错误;B项,阴极区产生![]() ,则
,则![]() 增大,故B项错误;C项,
增大,故B项错误;C项,![]() 电极反应式为:
电极反应式为:![]() ,故C项错误。D项,设开始时K2CrO4的物质的量是amol,有
,故C项错误。D项,设开始时K2CrO4的物质的量是amol,有
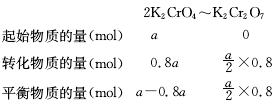 ,
,
则阳极区钾元素物质的量:![]() ,铬元素物质的量:
,铬元素物质的量:![]() ,
,![]() 故D项正确;答案为D。
故D项正确;答案为D。

练习册系列答案
相关题目