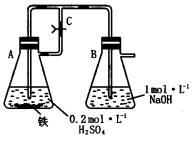
题目内容
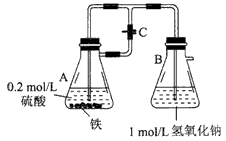
(2)若弹簧夹C关闭一会儿,容器A中的反应还在进行时,B容器中有什么现象发生?__________写出B容器中有关反应的化学方程式:____________
(3)若先打开弹簧夹C一段时间,容器A中的反应还在进行时,再关闭弹簧夹C一会儿,B容器中有什么现象发生?_______________
(2)容器A中溶液进入容器B,容器B中有白色沉淀生成,沉淀迅速变为灰绿色,最后变成红褐色;
2NaOH+FeSO4=Fe(OH)2↓+Na2SO4, 4Fe(OH)2+O2+2H2O=4Fe(OH)3
(3)开始时容器B中的导管口有气泡冒出,弹簧夹关闭后容器A中溶液进入容器B中,有白色沉淀生成。

 阅读快车系列答案
阅读快车系列答案A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y,A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物。回答下列问题:
(1)常温下,X、Y的水溶液的pH均为5。则两种水溶液中由水电离出的H+浓度之比是 。
(2)A、B、D、E四种元素组成的某无机化合物,受热易分解。写出少量该化合物溶液与足量的Ba(OH)2溶液反应的离子方程式 。
(3)A、B、D、E四种元素组成的某无机化合物浓度为 0.1 mol/L时, pH最接近 。
A.5.6 B.7.0 C.8.4 D.13.0
(4)化学反应3A2(g)+C2(g)![]() 2CA3(g)。ΔH=-92.4kJ·mol-1
2CA3(g)。ΔH=-92.4kJ·mol-1
|
和CA3的量),右图表示反应速率与反应过程的关
系,其中表示平衡混合物中CA3的含量最高的一段
时间是 。
②温度为T℃时,将4amolA2和2a molC2放入1L
密闭容器中,充分反应后测得C2的转化率为50%,
则反应的平衡常数 。
③在500℃、2.02×107Pa和铁催化条件下向一密闭容器中充入1molC2和3molA2,充分反应后,放出的热量______(填“<”“>”“=”)92.4kJ,理由是________ ____;
(5)已知0.4mol 液态C2 A4与足量的液态双氧水反应,生成C2和水蒸气,放出256.65 kJ
的热量。写出该反应的热化学方程式 。
 I、如图所示,在容器A中装有20℃的水50mL,容器B中装有1mol/L的盐酸50mL,试管C、D相连通,且其中装有红棕色NO2和无色N2O4的混合气体,并处于下列平衡:2NO2?N2O4△H=-57kJ/mol,当向A中加入50gNH4NO3晶体使之溶解;向B中加入2g苛性钠时:
I、如图所示,在容器A中装有20℃的水50mL,容器B中装有1mol/L的盐酸50mL,试管C、D相连通,且其中装有红棕色NO2和无色N2O4的混合气体,并处于下列平衡:2NO2?N2O4△H=-57kJ/mol,当向A中加入50gNH4NO3晶体使之溶解;向B中加入2g苛性钠时: