题目内容
11.下列反应可用离子方程式“H++OH-=H2O”表示的是( )| A. | NaHSO4溶液与Ba(OH)2溶液混合 | B. | HNO3溶液与澄清石灰水混合 | ||
| C. | NH4Cl溶液与KOH溶液混合 | D. | Na2HPO4溶液与NaOH溶液混合 |
分析 H++OH-=H2O表示可溶性强碱与强酸(或者可溶性强酸的酸式盐)反应生成可溶性盐和水,据此分析解答.
解答 解:A.二者反应生成硫酸钡、氢氧化钠和水,硫酸钡在离子反应中保留化学式,不能用H++OH-=H2O表示,故A不选;
B.HNO3溶液与澄清石灰水溶液混合,反应实质是氢离子与氢氧根离子反应生成水,离子方程式:H++OH-=H2O,故B选;
C.NH4Cl溶液与KOH溶液混合反应实质是铵根离子与氢氧根离子反应生成一水合氨为弱电解质,不能用H++OH-=H2O表示,故C不选;
D.磷酸二氢根离子为多元弱酸根离子,不能拆,所以Na2HPO4溶液与NaOH溶液混合不能用H++OH-=H2O表示,故D不选;
故选B.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应的离子反应考查,注意化学式的拆分,题目难度不大.

练习册系列答案
相关题目
1.雾霾天气严重影响人们的生活,其中氮氧化物和硫氧化物是造成雾霾天气的主要原因之一.消除氮氧化物和硫氧化物有多种方法.
(1)用活性炭还原法可以处理氮氧化物.某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应:C(s)+2NO(g)?N2(g)+CO2(g)△H=Q kJ•mol-1.在T1℃时,反应进行到不同时间测得
各物质的浓度如下:
①0~10min内,NO的平均反应速率v(NO)=0.042mol/(L•min),T1℃时,该反应的平衡常数K=$\frac{9}{16}$.
②30min后,只改变某一条件,反应重新达到平衡,根据表中的数据判断改变的条件可能是bc (填
字母).
a.加入一定量的活性炭 b.通入一定量的NO
c.适当缩小容器的体积 d.加入合适的催化剂
③若30min后升高温度至T2℃,达到平衡时,容器中,NO、N2、CO2的浓度之比为5:3:3,则Q<(填“>”、“=”或“<”)0.
(2)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术.反应原理如图所示:

①由图甲可知,SCR技术中的氧化剂为NO、NO2.已知c(NO2):c(NO)=1:1时脱氮效果最佳,
若生成1mol N2时反应放出的热量为Q kJ.此时对应的脱氮反应的热化学方程式为2NH3(g)+NO(g)+NO2(g)=2N2(g)+3H2O(g)△H=-2QkJ•mol-1
②图乙是不同催化剂Mn和Cr在不同温度下对应的脱氮率,由图可知工业使用的最佳的催化剂和相
应的温度分别为Mn、200℃左右.
(3)汽车尾气中的SO2可用石灰水来吸收,生成亚硫酸钙浊液.已知常温下Ka1(H2SO3)=1.8×10-2,Ka2(H2SO3)=6.0×10-9.常温下,测得某纯CaSO3与水形成的浊液pH=9,忽略SO32-的第二步水解,则Ksp(CaSO3)=4.2×10-9.
(1)用活性炭还原法可以处理氮氧化物.某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应:C(s)+2NO(g)?N2(g)+CO2(g)△H=Q kJ•mol-1.在T1℃时,反应进行到不同时间测得
各物质的浓度如下:
| 时间(min) 浓度(mol•L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
②30min后,只改变某一条件,反应重新达到平衡,根据表中的数据判断改变的条件可能是bc (填
字母).
a.加入一定量的活性炭 b.通入一定量的NO
c.适当缩小容器的体积 d.加入合适的催化剂
③若30min后升高温度至T2℃,达到平衡时,容器中,NO、N2、CO2的浓度之比为5:3:3,则Q<(填“>”、“=”或“<”)0.
(2)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术.反应原理如图所示:

①由图甲可知,SCR技术中的氧化剂为NO、NO2.已知c(NO2):c(NO)=1:1时脱氮效果最佳,
若生成1mol N2时反应放出的热量为Q kJ.此时对应的脱氮反应的热化学方程式为2NH3(g)+NO(g)+NO2(g)=2N2(g)+3H2O(g)△H=-2QkJ•mol-1
②图乙是不同催化剂Mn和Cr在不同温度下对应的脱氮率,由图可知工业使用的最佳的催化剂和相
应的温度分别为Mn、200℃左右.
(3)汽车尾气中的SO2可用石灰水来吸收,生成亚硫酸钙浊液.已知常温下Ka1(H2SO3)=1.8×10-2,Ka2(H2SO3)=6.0×10-9.常温下,测得某纯CaSO3与水形成的浊液pH=9,忽略SO32-的第二步水解,则Ksp(CaSO3)=4.2×10-9.
2.下列物质中,氯元素化合价最低的是( )
| A. | Cl2 | B. | HCl | C. | HClO | D. | KClO3 |
6.下列物质属于天然高分子化合物的是( )
| A. | 蛋白质 | B. | 聚氯乙烯 | C. | 蔗糖 | D. | 油脂 |
16.下列叙述中正确的是( )
| A. | 两份质量相同的Al分别加入到足量NaOH溶液和盐酸中充分反应,盐酸增加的质量大 | |
| B. | 两份质量相同的S分别与足量NaOH溶液和Na反应,两者转移的电子数相同 | |
| C. | 相同物质的量的CO2、H2O分别与足量Na2O2反应,生成气体的物质的量相同 | |
| D. | H2分别通过灼热的CuO和Fe2O3粉末,当转移电子数相同时,Fe2O3减轻的质量大 |
3.由羟基与下列基团组成的化合物中,属于醇类的是( )
| A. | NH2- | B. |  | C. | 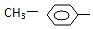 | D. | R-CO- |
20.下列有机物中,不属于羧酸的是( )
| A. | HCOOH | B. | CH3CH2COOH | C. | CH3COOCH3 | D. | HOOC-COOH |
2.下列物质中,可用于制作太阳能电池的是( )
| A. | Si | B. | SiO2 | C. | H2SiO3 | D. | Na2SiO3 |


 .
.