题目内容
获取知识和信息是现代人不可缺少的素质,信息产业的飞速发展离不开材料科学的推动。信息产业的核心材料是高纯度的硅,单晶硅可用来制作大规模集成电路、整流器等,硅纯度越高,大规模集成电路的性能就越好。高纯度的单晶硅生产方法有:
方法一:三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:

方法二:用金属硅化物(Mg2Si)与盐酸作用制得硅烷,再热分解硅烷可得高纯硅。
根据上述信息回答以下问题:
(1)从方法一生产单晶硅的过程看,由焦炭还原得到的硅为何还要进一步处理?_________________________________________________________。
(2)写出方法二中生产高纯硅的两个化学方程式:
①____________________________________________________________;
②__________________________________________________________。
(3)写出由纯SiHCl3制备高纯硅的化学方程式:____________________________________。
(4)在方法一中,整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式:________________;H2还原SiHCl3过程中若混入O2,可能引起的后果是_____________________________________________________。
(5)比较方法一和方法二,分析一下各自的优缺点____________________________________。
(1)由C还原SiO2得到的单质硅中,杂质含量过高,将它用HCl、Cl2处理得到低沸点SiHCl3,便于蒸发提纯,然后再还原得高纯硅
(2)①Mg2Si+4HCl=2MgCl2+SiH4↑
②SiH4 Si+2H2
Si+2H2
(3)SiHCl3+H2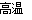 Si+3HCl
Si+3HCl
(4)SiHCl3+3H2O=H2SiO3+3HCl+H2↑
Si被氧化成SiO2而得不到Si单质, H2和O2混合发生爆炸
(5)方法一的优点是原料来源丰富,但与方法二相比,步骤较复杂,方法二的优点是流程简单,缺点是原料需要制备
【解析】(1)C还原SiO2得到的单质硅是粗硅,杂质的含量高,需要进一步的提纯处理;(2)Mg2Si与盐酸作用生成硅烷,同时生成MgCl2;(3)注意副产物为HCl;(4)SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学方程式:SiHCl3+3H2O=H2SiO3+H2↑+3HCl;H2还原SiHCl3过程中若混入O2,可能引起的后果是:高温下,H2遇O2发生爆炸。

