题目内容
【题目】图表示的是往某Na2CO3溶液中滴入稀盐酸产生CO2气体的过程。
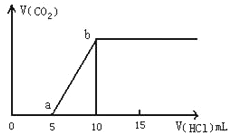
(1)写出a点以前发生反应的离子方程式: 。
(2)写出a点到b点发生反应的离子方程式: 。
(3)若某Na2CO3溶液中含m mol Na2CO3,向其中滴入一定量的稀盐酸,恰好使溶液中Cl-和HCO3-的物质的量之比为2:1,则滴入稀盐酸的物质的量等于 mol(用m表示)。
【答案】
(1)CO![]() +H+=HCO3-
+H+=HCO3-
(2)HCO3-+H+=H2O+CO2↑(3)![]()
【解析】
试题分析:(1)碳酸钠和少量的盐酸之间反应生成的是碳酸氢钠和氯化钠,即Na2CO3+HCl=NaCl+NaHCO3,故答案为:Na2CO3+HCl=NaCl+NaHCO3;
(2)碳酸氢钠和盐酸反应生成的是氯化钠、水以及二氧化碳,实质是:HCO3-+H+=H2O+CO2↑,故答案为:HCO3-+H+=H2O+CO2↑;
(3)设和碳酸氢钠反应的盐酸的物质的量是x,
Na2CO3+HCl=NaCl+NaHCO3
1 1 1 1
m m m m
NaHCO3+HCl=NaCl+H2O+CO2↑
1 1 1
x x x
则Cl-的物质的量为:m+x,HCO3-的物质的量为:m-x,使Cl-和HCO3-的物质的量比是2:1,即![]() =
=![]() ,解得x=
,解得x=![]() mol,加入盐酸的物质的量=
mol,加入盐酸的物质的量=![]() mol+mmol=
mol+mmol=![]() mol,故答案为:
mol,故答案为:![]() mol.
mol.

练习册系列答案
相关题目

