题目内容
(2007?资阳二模)已知NaHSO4 在水溶液中的电离方程式为:NaHSO4═Na++H++SO42-.某温度下,蒸馏水的 pH=6,向其中加入NaHSO4晶体.测得溶液的pH=2,对于该溶液,下列叙述中不正确的是( )
分析:A.25℃时纯水中pH=7,水的电离是吸热反应,升高温度促进水电离;
B.酸溶液中,水电离出的氢离子浓度等于溶液中氢氧根离子浓度;
C.根据电荷守恒和物料守恒分析;
D.纯水的pH=6,说明Kw=1×10-12,混合溶液呈中性,说明溶液的pH=6.
B.酸溶液中,水电离出的氢离子浓度等于溶液中氢氧根离子浓度;
C.根据电荷守恒和物料守恒分析;
D.纯水的pH=6,说明Kw=1×10-12,混合溶液呈中性,说明溶液的pH=6.
解答:解:A.25℃时pH=7,pH=6说明促进了水的电离,故T>25℃,故A正确;
B.该溶液为强酸溶液,氢离子浓度为0.01mol/L,则氢氧根离子浓度=
mol/L=10-10mol?L-1,该溶液中水电离出的氢离子浓度等于氢氧根离子浓度10-10mol?L-1,故B正确;
C.根据电荷守恒得c(H+)+c(Na+)=c (OH-)+2c(SO42-),根据物料守恒得c(Na+)=c(SO42-),所以得c(H+)=c(OH-)+c(SO42-),故C正确;
D.c(NaHSO4)0.01mol/L,c(NaOH)=1mol/L,二者等体积混合,溶液呈碱性,故D错误;
故选:D.
B.该溶液为强酸溶液,氢离子浓度为0.01mol/L,则氢氧根离子浓度=
| 10-12 |
| 0.01 |
C.根据电荷守恒得c(H+)+c(Na+)=c (OH-)+2c(SO42-),根据物料守恒得c(Na+)=c(SO42-),所以得c(H+)=c(OH-)+c(SO42-),故C正确;
D.c(NaHSO4)0.01mol/L,c(NaOH)=1mol/L,二者等体积混合,溶液呈碱性,故D错误;
故选:D.
点评:本题考查水的电离,注意水的离子积常数与溶液的温度有关,明确影响水的电离的因素即可解答,难度不大,注意该温度下水的离子积常数不是10-14.

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目
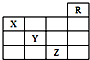 (2007?资阳二模)如图是元素周期表的一部分,关于元素X、Y、Z的叙述正确的是( )
(2007?资阳二模)如图是元素周期表的一部分,关于元素X、Y、Z的叙述正确的是( )